
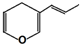
 互为同分异构体,且能与NaOH溶液反应的化合物有( )
互为同分异构体,且能与NaOH溶液反应的化合物有( )| A. | 9 种 | B. | 8 种 | C. | 7 种 | D. | 10 种 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AgCl悬浊液中加入KI溶液:AgCl(s)+I-(aq)═AgI(s)+Cl-(aq) | |
| B. | 明矾净水:Al3++3H2O?Al(OH)3+3H+ | |
| C. | 90℃时,测得纯水中Kw=3.8×10-13:H2O(l)?H+(aq)+OH-(aq)△H<0 | |
| D. | 用热的纯碱溶液可以清洗油污:CO32-+H2O?HCO3-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
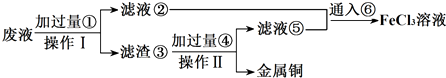
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,有关该晶体的说法正确的是
,有关该晶体的说法正确的是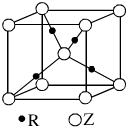
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心就是利用化学原理减少和消除工业生产对环境的污染 | |
| B. | 石油是由多种碳氢化合物组成的混合物 | |
| C. | 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 | |
| D. | 煤的干馏是将煤隔绝空气加强热使之分解的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)=2c(X2-) | B. | c(OH-)=c(H+)+2c(H2X)+c(HX-) | ||
| C. | c(X-)>c(Na+)>c(OH-)>c(H+) | D. | c(Na+)+c(H+)=c(OH-)+c(X2-)+c(HX-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 制得的碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案.请回答下列有关问题
制得的碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案.请回答下列有关问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
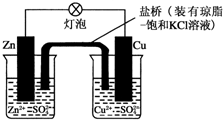
| A. | 正极反应为:Zn-2e-═Zn2+ | B. | 电池反应为:Zn+Cu2+═Zn2++Cu | ||
| C. | 当有1mol电子转移时,锌极减轻65g | D. | 盐桥中的K+移向ZnSO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com