
| A. | 达到化学平衡时,5v正(O2)=4v逆(NO) | |
| B. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 | |
| C. | 达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 达到平衡前,化学反应速率关系:3v正(NH3)=2v正(H2O) |
分析 A、反应处于平衡状态时,不同物质表示正逆反应速率之比等于化学计量数之比;
B、都表示向反应正向进行,反应自始至终都是1:1,不能说明到达平衡;
C、增大容器体积即减小压强,则正逆反应速率都减小;
D、速率之比始终等于化学计量数之比.
解答 解:A、反应处于平衡状态时,不同物质表示正逆反应速率之比等于化学计量数之比,4v正(O2)=5v逆(NO),反应到达平衡状态,故A错误;
B、若单位时间内生成xmolNO的同时,消耗xmolNH3,都表示反应向正向进行,反应自始至终都是1:1,不能说明到达平衡,故B错误;
C、增大容器体积即减小压强,则正逆反应速率都减小,故C错误;
D、达到平衡前,化学反应速率关系始终等于化学计量数之比,所以3v正(NH3)=2v正(H2O),故D正确;
故选D.
点评 本题考查化学平衡状态的判断、平衡移动及影响平衡的因素等,题目难度中等,A选项中注意用不同物质的表示的正逆反应速率相等的表达方法,此为易错点.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| B. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5微粒均具有丁达尔效应 | |
| C. | 福尔马林可作食品的保鲜剂 | |
| D. | 浓硫酸可刻蚀石英制艺术品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量浓硫酸沾在皮肤上,立即用大量氢氧化钠溶液冲洗 | |
| B. | 制取蒸馏水时,为了防止瓶内产生暴沸现象,应先向烧瓶内加几片碎瓷片 | |
| C. | 配制稀硫酸时,可先在量筒中加一定体积的水,再在搅拌下慢慢加入浓硫酸 | |
| D. | 不慎洒出的酒精在桌上着火时,应立即用大量水扑灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
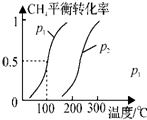 甲醇是一种重要的化工原料,在生产中有着重要的应用.工业上用天然气为原料,分为两阶段制备甲醇:
甲醇是一种重要的化工原料,在生产中有着重要的应用.工业上用天然气为原料,分为两阶段制备甲醇:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠溶液是电解质 | |
| B. | 因为醋酸是弱电解质,所以醋酸在熔融状态下和在溶液中都不能导电 | |
| C. | 在氢气还原氧化铜的实验中,氢气是氧化剂 | |
| D. | 胶体的本质特征是粒子大小在1nm-100nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④①②⑤⑥③ | B. | ④①②⑥⑤③ | C. | ①④②⑥③⑤ | D. | ①④②③⑥⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com