
【题目】香料甲和G都在生活中有很多用途,其合成路线如下:

已知:①R1—CHO+R2—CH2—CHO![]()
![]() (R1、R2代表烃基或氢原子)
(R1、R2代表烃基或氢原子)
②D与A互为同系物;在相同条件下,D蒸气相对于氢气的密度为39。
(1)A的名称是____,G中含氧官能团的名称是____。
(2)②的反应类型是____,B和F的结构简式分别为______、______。
(3)写出一种能鉴别A和D的试剂:______;C有多种同分异构体,其中属于芳香族化合物的有____种。
(4)写出反应①的化学方程式:_____________。
(5)G的同分异构体 是一种重要的药物中间体,其合成路线与G相似,请以
是一种重要的药物中间体,其合成路线与G相似,请以![]() 为原料设计它的合成路线(其他所需原料自选)_________。
为原料设计它的合成路线(其他所需原料自选)_________。
【答案】 甲苯 羧基 加成反应 ![]()
![]() 酸性高锰酸钾溶液 4
酸性高锰酸钾溶液 4 ![]() +CH3COOH
+CH3COOH![]()
![]() +H2O
+H2O 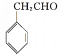
![]()
![]()
![]()
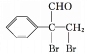
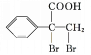
![]()
【解析】由C→![]() 及反应条件可知C为苯甲醇,B为
及反应条件可知C为苯甲醇,B为![]() ,A为甲苯。在相同条件下,D的蒸气相对于氢气的密度为39,则D的相对分子质量为39×2=78,D与A互为同系物,由此知D为芳香烃,设1个D分子中含有n个碳原子,则有14n-6=78,解得n=6,故D为苯;
,A为甲苯。在相同条件下,D的蒸气相对于氢气的密度为39,则D的相对分子质量为39×2=78,D与A互为同系物,由此知D为芳香烃,设1个D分子中含有n个碳原子,则有14n-6=78,解得n=6,故D为苯;![]() 与乙醛反应得到E,结合信息①,E为
与乙醛反应得到E,结合信息①,E为![]() ,E与溴发生加成反应得到的F为
,E与溴发生加成反应得到的F为 ,F发生氧化反应生成的G为
,F发生氧化反应生成的G为![]() 。
。
(1)根据分析可知,A为甲苯,G为![]() ,则G中含氧官能团为羧基,故答案为:甲苯; 羧基;
,则G中含氧官能团为羧基,故答案为:甲苯; 羧基;
(2)反应②为苯甲醛与氯仿发生加成反应生成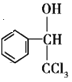 ,根据上述分析,B和F的结构简式分别为
,根据上述分析,B和F的结构简式分别为![]() 、
、![]() ,故答案为:加成反应;
,故答案为:加成反应;![]() ;
;![]() ;
;
(3)甲苯能使酸性高锰酸钾溶液褪色,而苯不能;C为苯甲醇属于芳香族化合物的苯甲醇的同分异构体有邻甲基苯酚、间甲基苯酚、对甲基苯酚和苯甲醚(![]() ),共4种,故答案为:酸性高锰酸钾溶液;4;
),共4种,故答案为:酸性高锰酸钾溶液;4;
(4)反应①为乙酸和![]() 发生酯化反应,化学方程式为
发生酯化反应,化学方程式为![]() +CH3COOH
+CH3COOH![]()
![]() +H2O,故答案为:
+H2O,故答案为:![]() +CH3COOH
+CH3COOH![]()
![]() +H2O;
+H2O;
(5)苯乙醛与甲醛反应生成![]() ,
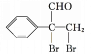
,![]() 再与溴发生加成反应生成
再与溴发生加成反应生成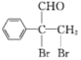 ,最后
,最后 发生催化氧化反应生成
发生催化氧化反应生成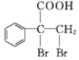 ,故合成路线为
,故合成路线为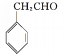
![]()
![]()
![]()
![]()
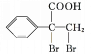 ,故答案为:
,故答案为:
![]()
![]()
![]()

![]()
 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用 0.50molL﹣1NaOH标准液10.00mL,将未知浓度的盐酸20.00mL恰好滴定至终点,下列说法正确的是( )
A.若选用酚酞作指示剂,终点时,液体恰好褪色
B.用量筒量取上述盐酸
C.若滴定完毕,滴定管尖嘴悬有一滴液体,则所测的盐酸浓度偏大
D.盐酸的浓度为1.00 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,H2SO3及其钠盐的溶液中,H2SO3、HSO3-、SO32-的物质的量分数(α)随溶液pH变化关系如下图所示,下列叙述错误的是( )
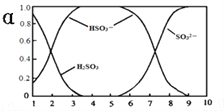
A. 溶液的pH=5时,硫元素的主要存在形式为HSO3-
B. 当溶液恰好呈中性时:c(Na+)>c(SO32-)+c(HSO3-)
C. 向pH=8的上述溶液中滴加少量澄清石灰水,![]() 的值增大
的值增大
D. 向pH=3的上述溶液中滴加少量稀硫酸,α(HSO3-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10.0mL 0.10molL﹣1氨水中滴入0.10molL﹣1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( ) 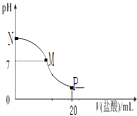
A.M﹣N间一定存在c(Cl﹣)>c(NH4+)>c(OH﹣)>c(H+)
B.M点对应的盐酸体积为10.0mL
C.pH=7溶液中有c(NH4+)=c(Cl﹣)=c(H+)=c(OH﹣)
D.P点处的溶液中存在:2c(NH4+)+2c(NH3H2O)=c(Cl﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用X表示原子:
(1)中性原子的中子数:N=________。
(2)阴离子的中子数:AXn-共有x个电子,则N=________。
(3)中性分子中子数:12C18O2分子中,N=________。
(4)A2-原子核内有x个中子,其质量数为m,则n gA2-所含电子的物质的量为________mol。
(5)某元素的同位素X,其氯化物XCl2。1.11 g溶于水制成溶液后,加入1 mol/L的AgNO3溶液20 mL恰好完全反应。若这种同位素原子核内有20个中子,则:X元素在周期表中的位置_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298 K时,各反应的平衡常数如下:
①N2(g)+O2(g)![]() 2NO(g),K=1×10-30;
2NO(g),K=1×10-30;
②2H2(g)+O2(g)![]() 2H2O(g),K=2×1081;
2H2O(g),K=2×1081;
③2CO2(g)![]() 2CO(g)+O2(g),K=4×10-92
2CO(g)+O2(g),K=4×10-92
则常温下,NO、H2O、CO2这三个化合物分解放氧的倾向最大的是( )
A.① B.② C.③ D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学一选修3:物质结构与性质】铁、钻、镍等金属及其化合物在科学研究和工业生产中应用十分广泛。回答下列问题:
(1)基态钴原子的价电子排布式为________,铁、钴、镍的基态原子核外未成对电子数最少的是_____________
(2)酞菁钴分子的结构简式如图所示,中心离子为钴离子,酞钴分子中与钴离子通过配位键结合的氮原子的编号是__________ (填1、2、3、4),三种非金属原子的电负性由大到小的顺序为____(用相应的元素符号表示);碳原子的杂化轨道类型为_________
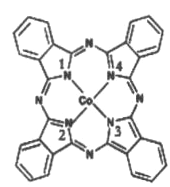
(3)Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO) x晶体属于_______ (填晶体类型),若配合物Fe(CO) x的中心原子价电子数与配体提供电子数之和为18,则x=_________
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO ______ FeO(填“>”“<”或“=”),原因是___________________________。
(5)NiAs的晶胞结构如图所示:
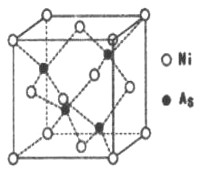
①镍离子的配位数为_________。
②若阿伏加德罗常数的值为NA,晶体密度为pg.cm-1,则该晶胞中最近的离子之间的距离为_____cm。(写出计算表达式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com