


科目:高中化学 来源: 题型:解答题
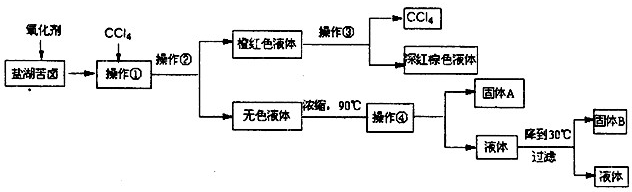
| 化学式 | BaCO3 | BaSO4 | Ca(OH)2 | MgCO3 | Mg(OH)2 |
| Ksp | 8.1×10一9 | 1.08×10一10 | 1.0×10一4 | 3.5×10一5 | 1.6×10一11 |
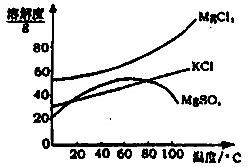
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
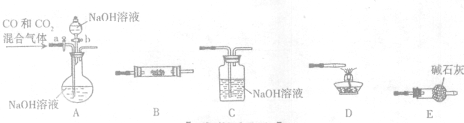
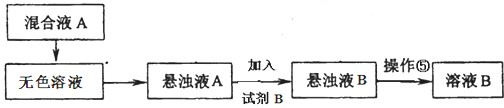
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
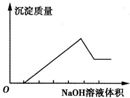 某无色溶液只可能含以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤Ba2+、⑥Cl-、⑦OH-、⑧
某无色溶液只可能含以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤Ba2+、⑥Cl-、⑦OH-、⑧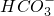 .向其中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定原溶液中一定大量存在的离子是
.向其中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定原溶液中一定大量存在的离子是查看答案和解析>>
科目:高中化学 来源: 题型:单选题
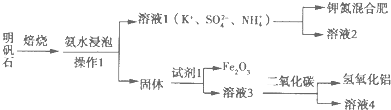
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液的体积(mL) | 标准溶液的体积 | |
| 初读数(mL) | 末读数(mL) | ||
| 1 | 10.00 | 0.00 | 14.90 |
| 2 | 10.00 | 0.10 | 15.05 |
| 3 | 10.00 | 0.50 | 17.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com