
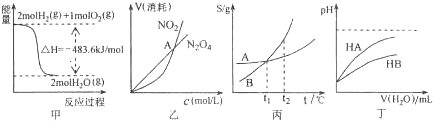
| A. | 甲图表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ•mol-1 | |
| B. | 乙图表示恒温恒容条件下发生的可逆反应2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 丙图表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数仍为A%=B% | |
| D. | 丁图表示常温下,稀释HA、HB两种酸的稀溶液时,溶液的pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液 |
分析 A、依据燃烧热概念分析,1mol可燃物完全燃烧生成稳定氧化物放出的热量;
B、根据平衡时正逆反应速率相等,反应速率之比等于化学计量数之比来分析;
C、根据将A、B饱和溶液分别由T1℃升温至T2℃时两溶液中溶质和溶剂的量都不会改变进行判断;
D、常温下,稀释HA、HB两种酸的稀溶液时,溶液的pH随加水量的变化可知酸性:HA>HB,由此判断盐的水解程度.
解答 解:A、1mol可燃物完全燃烧生成稳定氧化物放出的热量,图中分析可知焓变是2mol氢气燃烧生成气态水放出的热量,不符合燃烧热概念,故A错误;
B、乙表示恒温恒容条件下发生的可逆反应2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,横坐标向右表示浓度增大,纵坐标向上表示物质消耗速率快,如果达到平衡状态,则二者消耗速率之比等于化学计量数之比即应该等于2:1,故B错误;
C、将A、B饱和溶液分别由t1℃升温至t2℃时溶液中溶质和溶剂的量都不会改变,而二者t1℃溶解度相同,即质量分数相同,所以t2℃时溶质的质量分数仍为A%=B%,故C正确;
D、常温下,稀释HA、HB两种酸的稀溶液时,溶液的pH随加水量的变化可知酸性:HA>HB,则NaB溶液中B?水解程度大,产生OH-浓度大,溶液的pH大,故D错误;
故选C.
点评 本题考查了各种图象的分析思路和变化特征的应用,主要是燃烧热的概念应用,平衡状态的判断,饱和溶液中溶质溶解度和质量分数的判断,弱酸稀释的pH变化判断酸的强弱.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
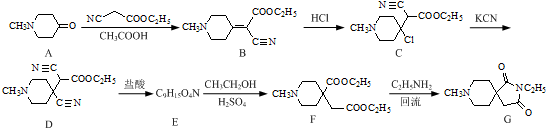
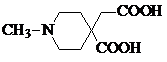 .
.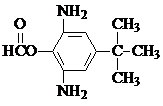 或
或 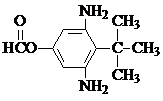 .
.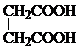 和CH3CH2Cl为原料制备
和CH3CH2Cl为原料制备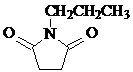 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
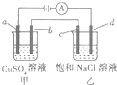 如图所示,a,b,c均为石墨电极,d为碳钢电极,通电电解一段时间,假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a,b,c均为石墨电极,d为碳钢电极,通电电解一段时间,假设在电解过程中产生的气体全部逸出,下列说法正确的是( )| A. | 甲、乙两烧杯中溶液的pH均保持不变 | |
| B. | 甲烧杯中b电极反应式为:Cu2++2e-═Cu | |
| C. | 当电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀 | |
| D. | 当b极增重3.2g时,d极产生的气体为0.56L(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由C(s,石墨)═C(s,金钢石)△H>0可知,金刚石比石墨稳定 | |
| B. | CO(g)燃烧热是283.0 kJ•mol-1,则2CO2(g)═2CO(g)+O2(g)△H=+566.0kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2+2H2O(I)△H<0,该反应的化学能可以转化为电能 | |
| D. | 已知C(s)+O2(g)═CO2(g)△H1,C(s)+$\frac{1}{2}$O2(g)═CO(g)△H2,则)△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 未加NaOH溶液时:c(H+)>c(Cl-)=c(CH3COOH) | |
| B. | 加入l0mLNaOH溶液时:c(CH3COO-)+c(OH-)=c(H+) | |
| C. | 加入20mLNaOH溶液时:c(Na+)=c(CH3COOH)+c(CH3COO一) | |
| D. | 加入20mLNaOH溶液时,酸碱恰好中和:c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的NaOH溶液中:K+、Na+、SO42-、CO32- | |
| B. | 0.1 mol•L-1的Na2CO3溶液中:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1 mol•L-1的FeCl3溶液中:K+NH4+、I-、SCN- | |
| D. | 0.1 mol•L-1的盐酸中:Fe2+、Na+、Br-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
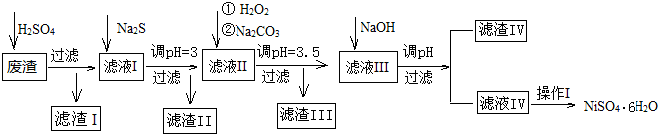
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | CuS | ZnS | FeS | NiS | Al(OH)3 | Mg(OH)2 | Ni(OH)2 |
| pH | 3.2 | 9.7 | ≥-0.42 | ≥2.5 | ≥7 | ≥7.5 | ≥5 | ≥8 | ≥8.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com