
| A. | n(FeO):n(Fe3O4)=1:1 | B. | n(Fe2O3):n(FeO)=2:1 | ||
| C. | n(Fe2O3):n(FeO)=1:2 | D. | n(Fe2O3):n(Fe3O4)=1:1 |
分析 反应中CO~CO2,固体质量减少为CO获得的氧原子质量,根据固体质量差计算减少O原子,根据守恒法计算反应后氧原子物质的量,反应中Fe原子物质的量不变,可以确定反应后氧化物中Fe、O原子数目之比,结合选项判断.
解答 解:固体质量减少为CO获得的氧原子质量,根据固体质量差,可知减少O原子质量为4.8g-4.56g=0.24g,减少O原子物质的量为$\frac{0.24g}{16g/mol}$=0.015mol,氧化铁的物质的量为$\frac{4.8g}{160g/mol}$=0.03mol,则反应后氧化物中O原子物质的量为0.03moL×3-0.015mol=0.075mol,反应中Fe原子物质的量不变,则反应后氧化物中Fe、O原子数目之比为0.03mol×2:0.075mol=4:5.
A.当n(FeO):n(Fe3O4)=1:1,则Fe、O原子数目之比为(1+3):(1+4)=4:5,故A正确;
B.当n(Fe2O3):n(FeO)=2:1,则Fe、O原子数目之比为(2+1):(3+1)=3:4,故B错误;
C.当n(Fe2O3):n(FeO)=1:2,则Fe、O原子数目之比为(2+1×2):(3+1×2)=4:5,故C正确;
D.当n(Fe2O3):n(Fe3O4)=1:1,则Fe、O原子数目之比为(2+3):(3+4)=5:7,故D错误,
故选:AC.
点评 本题以化学式确定为载体,考查学生分析计算能力,注意利用原子守恒解答,难度中等.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:选择题
| 实验内容 | 实验目的 | |
| A | 向新制氯水中滴加少量紫色石蕊试液,充分振荡后溶液先变红色后褪色 | 证明有氯水具有酸性 |
| B | 将Cl2通入NaBr溶液中,溶液变黄 | 比较氯气比液溴的氧化性强 |
| C | 向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出 | 证明氧化性:Cu2+>Fe3+ |
| D | 向某待测溶液中,加入BaCl2溶液,产生白色沉淀,继续滴加稀盐酸,沉淀不消失 | 证明待测溶液中含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 1-丁醇 | 冰醋酸 | |
| 密度(g/cm3) | 0.81 | 1.05 |
| 摩尔质量(g/mol) | 74 | 60 |
| A. | 产率:约54.49% | B. | 产率:约42.04% | ||
| C. | 转化率:冰醋酸小于1-丁醇 | D. | 转化率:冰醋酸大于1-丁醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解熔融NaCl制取Na,故电解熔融MgCl2也能制取Mg | |
| B. | Fe与CuSO4溶液反应置换出Cu,故Na也能从CuSO4溶液中置换出Cu | |
| C. | 通常元素的价态越高对应物质的氧化性越强,故HClO4的氧化性强于HClO | |
| D. | CO2和Na2O2反应生成Na2CO3和O2,故SO2和Na2O2反应生成Na2SO3和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
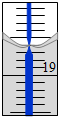
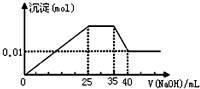 有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-,现取样逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.以下推测错误的是( )
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-,现取样逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.以下推测错误的是( )| A. | 原溶液一定不存在H+、Cu2+、CO32- | |
| B. | 不能确定原溶液是否含有K+、NO3- | |
| C. | 原溶液中n(Mg2+):n(Al3+):n(NH4+)=1:1:2 | |
| D. | 实验所加的NaOH溶液浓度为2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
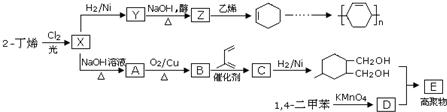
 .
. ;甲是A的一种同分异构体,其能实现转化:
;甲是A的一种同分异构体,其能实现转化: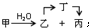 ,甲的名称为乙酸乙酯;
,甲的名称为乙酸乙酯;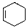 可以合成
可以合成 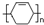 .按合成路线的顺序,涉及反应的反应类型有:加成、消去、加聚.
.按合成路线的顺序,涉及反应的反应类型有:加成、消去、加聚.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 软脂酸(C15H31COOH) | B. | 油酸(C17H33COOH) | ||
| C. | 草酸(HOOC-COOH) | D. | 氨基酸(H2N-CH2COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯化铝可制备无机高分子混凝剂,在有机合成中有广泛的用途.
氯化铝可制备无机高分子混凝剂,在有机合成中有广泛的用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钙的化学式是Ca2O2 | |
| B. | 1mol过氧化钠或过氧化钙跟足量水反应都生成0.5mol氧气 | |
| C. | 过氧化钙中阴阳离子数之比为2:1 | |
| D. | 过氧化钙中只含离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com