
分析 (1)原电池反应必须是自发进行的放热的氧化还原反应,根据是否有电子转移判断是否能设计成原电池;
(2)原电池反应必须是自发进行的放热的氧化还原反应;
(3)原电池反应中,化合价升高的金属单质作负极,不如负极活泼的金属或导电的非金属作正极,得电子化合价降低的电解质溶液作该原电池电解质溶液.
解答 解:(1)原电池反应必须是自发进行的放热的氧化还原反应,(A)中各元素化合价不变,所以不是氧化还原反应,属于复分解反应,不能设计成原电池;
(B)中反应前后Fe元素化合价由+3价变为+2价、Cu元素化合价由0价变为+2价,所以有电子转移,能设计成原电池,
故答案为:(1)不能,(B)可以;
(2)根据(1)知,(A)的反应非氧化还原反应,没有电子转移,所以(A)不能设计成原电池,
故答案为:(A)的反应非氧化还原反应,没有电子转移;
(3)原电池反应中,化合价升高的金属单质作负极,不如负极活泼的金属或导电的非金属作正极,得电子化合价降低的电解质溶液作该原电池电解质溶液,Fe元素化合价由+3价变为+2价、Cu元素化合价由0价变为+2价,根据元素化合价变化知,Cu作负极、不如铜活泼的金属或导电的非金属作正极,如碳棒,氯化铁溶液为电解质溶液,负极反应式、正极反应式分别为Cu-2e-=Cu2+、2Fe3++2e-=2Fe2+,
故答案为:负极:铜,Cu-2e-=Cu2+;正极:碳棒,2Fe3++2e-=2Fe2+;氯化铁溶液.
点评 本题考查原电池设计,侧重考查学生实验设计及原电池原理,知道原电池正负极及电解质溶液的判断方法,知道元素化合价升降与正负极材料的关系,题目难度不大.


科目:高中化学 来源: 题型:选择题
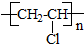
| A. | 消去反应 | B. | 取代反应 | C. | 加成反应 | D. | 加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-) | B. | c(HC2O4-)+c(C2O42-)=0.1mol•L-1 | ||
| C. | c(C2O42-)>c(H2C2O4) | D. | c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性Cl>Br,故将Cl2通入NaBr溶液中,发生反应为:Cl2+2Br-=Br2+2Cl- | |
| B. | 非金属性F>Br,故酸性:HF>HBr | |
| C. | 非金属性S>33As,故前者的气态氢化物稳定性更强 | |
| D. | 非金属性O>N,故O2与H2化合比N2更容易 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X可能是第二周期非金属元素 | B. | Y可能与X同主族 | ||
| C. | X可能是第三周期金属元素 | D. | Y一定是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钠是漂粉精的主要成分 | |
| B. | 氧化钠可用于呼吸面具 | |
| C. | 凡含有添加剂的食物对人体健康均有害,不宜食用 | |
| D. | “开发利用新能源”、“汽车尾气催化净化”都能提高空气质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com