
| A. | FeSO4(CuSO4):加足量铁粉后,过滤 | |
| B. | CO(CO2):用NaOH溶液洗气后干燥 | |
| C. | MnO2(KCl):加水溶解后,过滤、洗涤、烘干 | |
| D. | N2(O2):通过灼热的氧化铜 |
分析 A.Fe与硫酸铜反应生成硫酸亚铁和Cu;
B.NaOH与二氧化碳反应,与CO不反应;
C.KCl溶于水,二氧化锰不溶于水;
D.二者均不与CuO反应.
解答 解:A.Fe与硫酸铜反应生成硫酸亚铁和Cu,则加足量铁粉后,过滤可除杂,故A正确;
B.NaOH与二氧化碳反应,与CO不反应,则用NaOH溶液洗气后干燥可除杂,故B正确;
C.KCl溶于水,二氧化锰不溶于水,则加水溶解后,过滤、洗涤、烘干可除杂,故C正确;
D.二者均不与CuO反应,不能除杂,应选灼烧的Cu,故D错误;
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应及混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:实验题
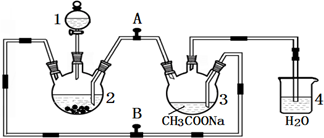
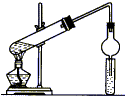 用如图所示装置制取乙酸乙酯,请回答以下问题.
用如图所示装置制取乙酸乙酯,请回答以下问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用到的玻璃仪器有:玻璃棒、胶头滴管、500mL容量瓶、烧杯 | |
| B. | 需要称量氢氧化钠固体1.92g | |
| C. | 没有等溶液冷却就转移将导致所配溶液浓度偏高 | |
| D. | 洗净的容量瓶不需要干燥就能使用,但使用前需检漏 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
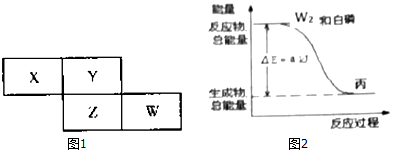
. .白磷固体和W2气体反应,生成1mol液态丙时,能量变化如图2所示,写出该反应的热化学方程式$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-akJ/mol.已知1mol白磷固体和W2气体反应,生成固态丁时,放热bkJ,则1mol固态丁转化为液态丙时的△H=($\frac{1}{4}$b-a)KJ/mol.
.白磷固体和W2气体反应,生成1mol液态丙时,能量变化如图2所示,写出该反应的热化学方程式$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-akJ/mol.已知1mol白磷固体和W2气体反应,生成固态丁时,放热bkJ,则1mol固态丁转化为液态丙时的△H=($\frac{1}{4}$b-a)KJ/mol.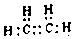 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量后转移固体时不小心把少量固体洒到烧杯外 | |
| B. | 加水定容时,加水过多,倒出后并恢复到刻度线水平 | |
| C. | 转移过程中不小心把几滴溶液滴在外面 | |
| D. | 干净的容量瓶又用蒸馏水洗涤了一遍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ① | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 醋酸亚铬水合物
醋酸亚铬水合物查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com