
| A. | 54 | B. | 92 | C. | 146 | D. | 238 |
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | C4H10的属于烷烃的同分异构体有3种 | |
| B. | 分子组成是C5H10属于烯烃的同分异构体有6种 | |
| C. | 分子组成是C4H8O属于醛类的同分异构体有3种 | |
| D. | 结构为 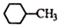 的物质的一溴代物有5种 的物质的一溴代物有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若1mol A2和1 mol B2的总能量之和大于生成的1 mol AB的总能量,则反应放热 | |
| B. | 若1mol A2和1 mol B2的总能量之和小于生成的2 mol AB的总能量,则反应放热 | |
| C. | 若该反应为放热反应,则Q1+Q2<2Q3 | |
| D. | 若该反应为吸热反应,则Q1+Q2<Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
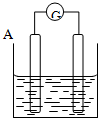 按要求回答下列问题:
按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物稳定性:PH3>CH4 | |
| B. | HCl的电子式为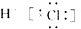 | |
| C. | D2O分子所有原子均达到最外层8e-稳定结构 | |
| D. | VIIA族元素中F的最高价氧化物对应水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
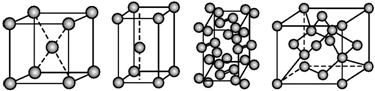
| A. | 碘、锌、钠、金刚石 | B. | 金刚石、锌、碘、钠 | C. | 钠、锌、碘、金刚石 | D. | 锌、钠、碘、金刚石 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
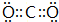 ,B与D形成的原子个数比为1:1的化合物乙的电子式是
,B与D形成的原子个数比为1:1的化合物乙的电子式是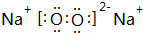 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com