
| A. | 实验中,乙烯的用量不会影响该反应的反应焓变△H | |
| B. | 0.5 mol H2O(l) 完全反应放出的热量为22.9 kJ | |
| C. | 1 mol C2H5OH(g)具有的能量大于1 mol C2H4(g)和1 mol H2O (g)所具有的能量和 | |
| D. | 1 mol C2H4(g)和1 mol H2O (g)中化学键的总键能大于1 mol C2H5OH(g)中化学键的总键能 |
分析 A.焓变与物质的用量无关;
B.反应中物质的量与热量成正比,则0.5 mol H2O(g) 完全反应放出的热量为22.9 kJ;
C.该反应为放热反应,反应物的总能量高;
D.焓变等于反应物中键能之和减去生成物中键能之和.
解答 解:A.焓变与物质的用量无关,则实验中,乙烯的用量不会影响该反应的反应焓变△H,故A正确;
B.反应中物质的量与热量成正比,则0.5 mol H2O(g) 完全反应放出的热量为22.9 kJ,则0.5 mol H2O(l) 完全反应放出的热量小于22.9 kJ,故B错误;
C.该反应为放热反应,反应物的总能量高,则1 mol C2H5OH(g)具有的能量小于1 mol C2H4(g)和1 mol H2O (g)所具有的能量和,故C错误;
D.焓变等于反应物中键能之和减去生成物中键能之和,该反应为放热反应,则1 mol C2H4(g)和1 mol H2O (g)中化学键的总键能小于1 mol C2H5OH(g)中化学键的总键能,故D错误;
故选A.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、焓变与物质能量及键能的关系为解答的关键,侧重分析与应用能力的考查,注意焓变的计算方法,题目难度不大.


科目:高中化学 来源: 题型:实验题
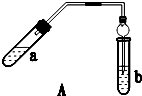 实验室制乙酸乙酯得主要装置如图A所示,主要步骤①在a试管中按2:3:2的体积比配制浓硫酸、乙醇、乙酸的混合物;②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;③小火加热a试管中的混合液;④等b试管中收集到约2mL产物时停止加热.撤下b试管并用力振荡,然后静置待其中液体分层;⑤分离出纯净的乙酸乙酯.
实验室制乙酸乙酯得主要装置如图A所示,主要步骤①在a试管中按2:3:2的体积比配制浓硫酸、乙醇、乙酸的混合物;②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;③小火加热a试管中的混合液;④等b试管中收集到约2mL产物时停止加热.撤下b试管并用力振荡,然后静置待其中液体分层;⑤分离出纯净的乙酸乙酯.| 实验 编号 | 试管a中试剂 | 试管b中试剂 | 测得有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL 18mol•L-1 浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol•L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
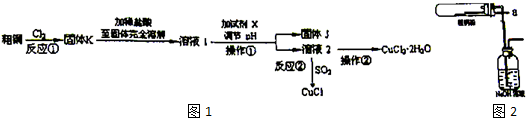
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
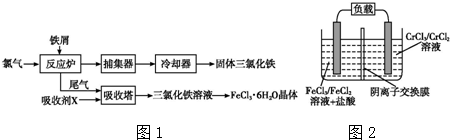
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
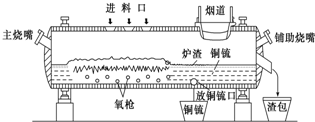
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+2HCl═CuCl2+H2↑ | B. | Al2O3+3H2O═2Al(OH)3 | ||
| C. | Mg(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ MgO+H2O | D. | Ba(OH)2+SO2═BaSO4↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com