
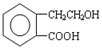
 ,它可通过不同化学反应分别制得B、C和D 三种物质.
,它可通过不同化学反应分别制得B、C和D 三种物质.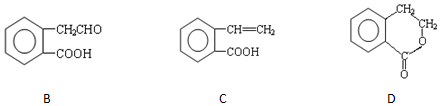
 +H2O
+H2O
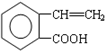
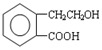 .
.

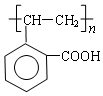 .
. 分析 (1)B中含-COOH和-CHO;
(2)A→B中-OH转化为醛基;分子式相同、结构不同的有机物互为同分异构体;
(3)C含有碳碳双键,可与水发生加成反应生成A;
(4)C含有碳碳双键,可发生加聚反应.
解答 解:(1)B中含-COOH和-CHO,名称为羧基、醛基,故答案为:醛基、羧基;
(2)A→B中-OH转化为醛基,反应类型为氧化反应;上述几种物质中,只有C、D的分子式相同、结构不同,二者互为同分异构体,
故答案为:氧化反应;CD
(3)C含有碳碳双键,可与水发生加成反应生成A,方程式 +H2O
+H2O 
 为,
为,
故答案为: +H2O
+H2O 
 ;
;
(4)C含有碳碳双键,可发生加聚反应,方程式为n

 ,
,
故答案为:n

 .
.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重官能团判断、同分异构体及醇性质的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na2S水解:S2-+2 H2O?H2S+2OH- | |
| B. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| C. | 向次氯酸钙溶液通入过量CO2:Ca2++2CIO-+H2O+CO2═CaCO3↓+2HClO | |
| D. | 向次氯酸钙溶液通入SO2:Ca2++2CIO-+H2O+SO2═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 说法1 | 说法2 | 判断 |
| A | Na+、Mg2+、O2-、F-中离子半径最大的是O2- | I的原子半径大于Br,HI比HBr的热稳定性强 | 说法1说法2均正确 |
| B | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 | 热稳定性:HCl>HI | 说法1说法2均正确 |
| C | 原子半径:Na>Mg | 酸性:H2SO3>H2SO4 | 说法1说法2均错误 |
| D | 同主族元素的简单阴离子还原性越强,水解程度越大 | 同周期金属元素的化合价越高,其原子失电子能力越强 | 说法1错误说法2正确 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和反应时并不一定都伴随着能量变化 | |
| B. | 所有的燃烧反应都是放热反应 | |
| C. | 只要有能量变化的都是化学变化 | |
| D. | 任何反应中的能量变化都表现为热量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
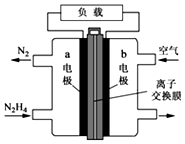 (1)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
(1)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 220 | 330 | 440 | 550 | 660 | 770 | 880 |
| 铜平均溶解速率(×10-3mol•L-1•min-1) | 77.34 | 88.01 | 99.25 | 77.98 | 77.24 | 66.73 | 55.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 第一电离能:Y一定小于X | |
| B. | 气态氢化物的稳定性:HmY小于HnX | |
| C. | 最高价含氧酸的酸性:X对应的酸性强于Y对应的 | |
| D. | X和Y形成化合物时,X显负价,Y显正价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com