
【题目】运用化学反应原理研究化学反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)![]() 2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
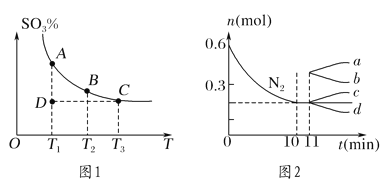
①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡________(填“向左”“向右”或“不”)移动。
②若反应进行到状态D时,v正________(填“>”“<”或“=”)v逆。
(2)课本里介绍的合成氨技术叫哈伯法:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是________(填编号)。
A.使用更高效的催化剂
B.升高温度
C.及时分离出氨气
D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2 L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用H2表示0~10 min内该反应的平均速率v(H2)=________。从第11 min起,压缩容器的体积为1 L,则n(N2)的变化曲线为________(填编号)。
【答案】 向左 > D 0.06 mol·L-1·min-1 d
【解析】(1)若在恒温、恒压条件下向上述平衡体系中通入氦气,体积膨胀,相当于减压,平衡向体积减小的方向移动,平衡向左移动。②若反应进行到状态D时,要达到平衡,须向生成SO3的方向进行,v正>v逆;(2))①A、使用的更高效催化剂,反应加快,不影响平衡移动,故A错误;B、升高温度,反应加快,平衡向吸热反应移动,即向逆反应移动,故B错误;C、降低生成物浓度,速率降低,平衡向正反应移动,故C错误;D、充入氮气,增大氮气的浓度,速率加快,平衡向体积减小方向移动,即平衡向正反应移动,故D正确.故选:D;②由图2可知,0~10min内氮气的物质的量变化为0.6mol-0.2mol=0.4mol,所以v(N2)=![]() =0.02mol/(Lmin),速率之比等于化学计量数之比,所以v(H2)=3v(N2)=3×0.02mol/(Lmin)=0.06mol/(Lmin),压缩体积,增大压强,平衡向正反应移动,改变瞬间n(N2)不变,平衡时n(N2)减小,故选d。
=0.02mol/(Lmin),速率之比等于化学计量数之比,所以v(H2)=3v(N2)=3×0.02mol/(Lmin)=0.06mol/(Lmin),压缩体积,增大压强,平衡向正反应移动,改变瞬间n(N2)不变,平衡时n(N2)减小,故选d。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】A,B,C,D,E为短周期元素,A,B,C在周期表中所处的位置如图所示,A,C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.D与A同周期,其最高正价与最低负价代数和为零.A,E可形成AE3型分子,分子中只存在极性键. ![]()
(1)B元素在元素周期表中的位置是 .
(2)C的离子结构示意图为 , 用电子式表示AE3的形成过程: .
(3)由元素A、C及氢元素形成的化合物中含有的化学键的类型有 .
(4)请设计一个实验来说明D与A的非金属性强弱(写出化学方程式即可) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶滚中可能含有Na+、NH4+、Ba2+、Cu2+、SO42﹣、SO32﹣、Cl﹣、Br﹣、CO32﹣中的若干种.为检验其中含有的离子,进行如下实验:
①取10mL溶液,加入足量氯水,无气体产生,再加入CCl4溶液分层,下层为橙红色;
②分液后,将①中上层溶液加入足量BaCl2和HCl溶液,产生白色沉淀2.33g;
③另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448mL气体.下列关于原溶液的说法正确的是
A. 肯定存在NH4+、Cl﹣、Br﹣
B. SO42﹣、SO32﹣至少含有一种
C. 是否存在Na+需要通过焰色反应来确定
D. 肯定不存在Ba2+、Cu2+、SO32﹣、CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向一带活塞的密闭容器中充入2molSO2和lmolO2,发生下列反应: 2SO2(g)+ O2(g)![]() 2SO3(g),达到平衡后改变下述条件,再次平衡后SO3气体浓度不变的是
2SO3(g),达到平衡后改变下述条件,再次平衡后SO3气体浓度不变的是
A. 保持温度和容器体积不变,充入1molSO3(g)
B. 保持温度和容器内压强不变,充入1molSO3(g)
C. 保持温度和容器内压强不变,充入1molO2(g)
D. 保持温度和容器内压强不变,充入1molAr(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭恒容容器中,能表示反应X(g)+2Y(g)![]() 2Z(g)一定达到化学平衡状态的是
2Z(g)一定达到化学平衡状态的是
①X、Y、Z的物质的量之比为:1:2:2 ②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化 ④单位时间内生成nmolZ,同时生成2nmolY
⑤X、Y、Z的浓度相等时 ⑥正反应和逆反应的速率均相等且都为零
⑦密闭容器内气体的密度不再变化 ⑧密闭容器内气体的平均相对分子质量不再变化
A. ①②⑤⑥ B. ①④⑦⑧ C. ②③⑧ D. ③④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,互为同分异构体的是( )
A.O2和O3B.CH3CH3和CH2=CH2
C.金刚石和石墨D.CH3CH2CH2CH3和CH3(CH3)CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸与强碱稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol,向1 L 0.5 mol/L的NaOH溶液中加入稀醋酸、浓H2SO4、稀HNO3,则恰好完全反应时的热效应ΔH1、ΔH2、ΔH3的关系正确的是
A.ΔH1>ΔH2>ΔH3B.ΔH1<ΔH3<ΔH2
C.ΔH2>ΔH1>ΔH3D.ΔH1>ΔH3>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某同学设计如下实验方案探究影响锌与稀硫酸反应速率的因素,有关数据如下表所示:
序号 | 纯锌粉(g) | 2.0 mol·L-1 硫酸溶液(mL) | 温度 (℃) | 硫酸铜固体(g) | 加入蒸馏水(mL) |
Ⅰ | 2.0 | 50.0 | 25 | 0 | 0 |
Ⅱ | 2.0 | 40.0 | 25 | 0 | 10.0 |
Ⅲ | 2.0 | 50.0 | 25 | 0.2 | 0 |
Ⅳ | 2.0 | 50.0 | 25 | 4.0 | 0 |
①本实验待测数据可以是________________________,实验Ⅰ和实验Ⅱ可以探究________________对锌与稀硫酸反应速率的影响。
②实验Ⅲ和实验Ⅳ的目的是________________,写出有关反应的离子方程式
_______________________________________________________________。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:

表中Vx=________mL,理由是_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com