
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/ml | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)始/ml | 0.00 | 0.20 | 0.10 | 0.10 |
| V(NaOH)终/ml | 14.98 | 15.20 | 15.12 | 16.24 |
分析 (1)根据配制一定物质的量浓度溶液的所需要的仪器来分析;根据蒸馏水中的CO2会影响结果的测定;
(2)根据酸碱反应生成了强碱弱酸盐,溶液呈碱性,应选择碱性变色范围内的指示剂;
(3)先分析数据的合理性,求出NaOH体积的平均值,然后根据醋酸与NaOH反应的关系式求出醋酸,最后求出测定食醋的总酸量;
(4)依据滴定实验过程中待测溶液浓度计算分析判断误差,c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$.
解答 解:(1)配制一定物质的量浓度的溶液,用到的仪器有:移液管、洗耳球、烧杯、玻璃棒、胶头滴管以及容量瓶等;蒸馏水要煮沸除去CO2并迅速冷,
故答案为:CO2;
(2)食醋与NaOH反应生成了强碱弱酸盐,溶液呈碱性,应选择碱性变色范围内的指示剂酚酞,
故答案为:酚酞;CH3COONa溶液呈碱性,应选择变色范围在碱性的指示剂;
(3)4次消耗的NaOH溶液的体积为:14.98mL;15.00mL;15.02mL;16.14mL;舍去第4组数据16.14mL,则NaOH溶液的体积的平均值为15.00mL;
设10mL市售白醋样品含有 CH3COOH Xg,则
CH3COOH~NaOH
60 40
Xg×0.2 0.1000mol/L×0.015L×40g/mol
X=0.450
则样品总酸量4.50g/100mL,
故答案为:4.50;
(4)c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$,标准溶液浓度、待测溶液体积一定,误差分析取决于标准溶液体积变化,
①滴定终点时,仰视滴定管读数,读取标准溶液体积增大,测定结果偏高,故①正确;
②滴定后滴定管尖嘴处悬有一滴液体,读取标准溶液体积增大,测定结果偏高,故②正确;
③移液管用蒸馏水洗净后,就用来吸取待测液,导致待测液浓度减小,结果偏低,故③错误;
④滴定前,碱式滴定管无气泡,滴定后产生气泡,读出的所用NaOH体积偏小,测定结果偏小,故④错误;
⑤锥形瓶只用蒸馏水洗涤后仍留有少量蒸馏水,对测定结果没有影响.故⑤错误;
故答案为:①②.
点评 本题主要考查了物质组成的测定和含量计算,中和滴定的操作与计算,试题有一定的灵活性,题目难度中等.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:解答题
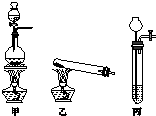 相对分子质量由小到大排列的X、Y、Z三种气体单质,组成这三种单质的元素分别位于不同的短周期.在一定条件下,X与Y化合生成M;X与Z化合生成N;M能与N化合生成A.实验室可分别用如图所示的发生装置制取X、Z和M(夹持装置已略).
相对分子质量由小到大排列的X、Y、Z三种气体单质,组成这三种单质的元素分别位于不同的短周期.在一定条件下,X与Y化合生成M;X与Z化合生成N;M能与N化合生成A.实验室可分别用如图所示的发生装置制取X、Z和M(夹持装置已略).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)
工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2═Na2O | |
| B. | 向AgCl悬浊液中滴加NaI溶液,白色沉淀变成黄色AgCl+I-═AgI+Cl- | |
| C. | Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2+2CO2═2Na2CO3+O2 | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
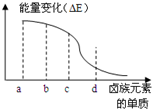 卤族元素的单质(F2、Cl2、Br2、I2)与H2反应过程中的能量变化如右图所示,其中a、b、c、d分别表示卤族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).请回答下列问题:
卤族元素的单质(F2、Cl2、Br2、I2)与H2反应过程中的能量变化如右图所示,其中a、b、c、d分别表示卤族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 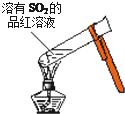 加热后溶液颜色变为无色 | B. |  配制100mL0.10mol•L-1NaCl溶液 | ||
| C. | 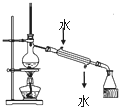 实验室用该装置制取少量蒸馏水 | D. |  称量25gNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
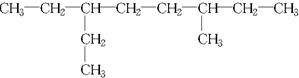
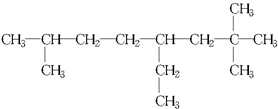
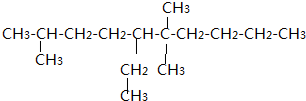 .
.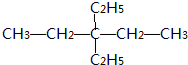 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com