
在2A(g)+B(g) 2C(g)+D(g)反应中,表示该反应速率最快的是
2C(g)+D(g)反应中,表示该反应速率最快的是
A.v(A)=0.8 mol·L-1·s-1 B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.6 mol·L-1·s-1 D.v(D)=0.5 mol·L-1·s-1
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源:2016-2017学年广东省汕头市高二上学期期中化学试卷(解析版) 题型:选择题
下列事实一定能证明HNO2是弱电解质的是( )
①常温下NaNO2溶液pH大于7
②用HNO2溶液做导电实验,灯泡很暗
③HNO2和NaCl不能发生反应
④0.1mol•L-1HNO2溶液的pH=2.1
⑤NaNO2和H3PO4反应,生成HNO2
⑥0.1mol•L-1HNO2溶液稀释至10倍,pH约为2.6
A.①②③ B.①②④⑥ C.①④⑤⑥ D.全部
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南师大附中高二上期中理化学试卷(解析版) 题型:填空题
向100 mL BaCl2、AlCl3、FeCl3的混合溶液A中逐滴加入Na2SO4和NaOH的混合溶液B,产生沉淀的物质的量n和加入溶液B的体积关系如下图所示:
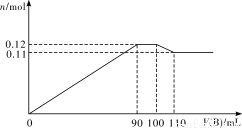
(1)当加入110 mL B溶液时,溶液中的沉淀是___________(填化学式)。
(2)溶液 B中Na2SO4和NaOH的物质的量浓度之比是___________。当B溶液加到90 mL~100 mL这一段时间中,所发生的离子反应方程式是____________________。
B中Na2SO4和NaOH的物质的量浓度之比是___________。当B溶液加到90 mL~100 mL这一段时间中,所发生的离子反应方程式是____________________。
(3)将A、B溶液中各溶质的物质的量浓度(c)填入下表中。
溶质 | Na2SO4 | NaOH | BaCl2 | AlCl3 | FeCl3 |
c/mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南师大附中高二上期中理化学试卷(解析版) 题型:选择题
准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.1000 mol·L-1NaOH溶液滴定,下列说法正确的是
A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南师大附中高二上期中理化学试卷(解析版) 题型:选择题
反应3Fe(s)+4H2O(g) Fe3O4+4H2(g)在一可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
Fe3O4+4H2(g)在一可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
A.增加Fe的物质的量
B.将容器的体积缩小一半
C.升高温度
D.压强不变,充入Ne使容器的体积增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高一上期中化学试卷(解析版) 题型:填空题
(本题 包括2小题,共8分)
包括2小题,共8分)
I、 向KI和硫酸混合溶液中加入过氧化氢溶液,迅速反应放出大量气泡,溶液呈棕色。
查阅资料知,反应过程如下:
①H2O2+2KI+H2SO4=I2+K2SO4+2H2O;
②H2O2+I2=2HIO;
③H2O2+2HIO=I2+O2↑+2H2O
(1)用双线桥法表示过程①电子转移情况:
H2O2+2KI+H2SO4=I2+K2SO4+2H2O
(2)上述实验过程②与③中,I2起到了___________的作用。
(3) 试判断,酸性条件下HIO、H2O2、O2三种物质氧化性的强弱:___________(填化学式)。
试判断,酸性条件下HIO、H2O2、O2三种物质氧化性的强弱:___________(填化学式)。
II、一定条件下,向含硝酸的废水中加入CH3OH,将HNO3还原成N2。若参加反应的还原剂和氧化剂的物质的量之比是5∶6,则该反应的氧化产物是 ;每转移3 mol电子,反应消耗 g CH3OH。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高一上期中化学试卷(解析版) 题型:选择题
某物质R完全燃烧的化学方程式为:2R+3O2 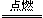 2CO2 + 4H2O 有关该反应,有下列说法:
2CO2 + 4H2O 有关该反应,有下列说法:
①R一定含碳、氢两种元素,可能含有氧元素
②R中碳元素的质量分数是37.5 %
③6.4g R完全燃烧,转移1.2NA个电子
④R的摩尔质量为32
若6.4 g R完全燃烧生成8.8 g CO2,则正确的一组是
A.① ② B. ③④ C.②④ D. ②③
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高一上期中化学试卷(解析版) 题型:填空题
冬天使用的热敷袋里面有铁粉、氯化钠、碳粉,利用铁被氧化放出的热量取暖。某同学拆开一袋后取里面的固体粉末进行实验:
①将粉末投入盛有足量稀盐酸的烧杯中,观察到有大量气泡产生,底部有黑色粉末。则发生反应 的离子方程式为 。
的离子方程式为 。
②为分离出反应后的溶液,可将上述烧杯中混合物进行 操作,该操作需要的玻璃仪器为 。
③在②得到的溶液中通入氯气,发生如下离子反应:2Fe2++Cl2=2Fe3++2Cl─;在该离子方程式中,当有ag氧化产物生成时,需通入标准状况下的氯气体积为 L(用含a的代数式表示)。
④该同学将少量铜片投入制得的含FeCl3的溶液中,发现铜 片慢慢溶解消失,溶液由黄色变为青绿
片慢慢溶解消失,溶液由黄色变为青绿 色。则发生反应的离子方程式为 。
色。则发生反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省襄阳市四校高一上学期期中化学试卷(解析版) 题型:填空题
已知铜和浓硫酸可以在加热条件下发生反应,化学方程式如下(已配平):
Cu+2H2SO4(浓)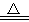 CuSO4
CuSO4 +A↑+2H2O
+A↑+2H2O
试通过计算和推理完成下面的问题:
(1)A物质可以与强碱反应生成盐和水,则A应该属于 (用字母代号填写)。
a.酸 b.碱 c.盐 d. 酸性氧化物 e.碱性氧化物
酸性氧化物 e.碱性氧化物
(2)该反应中被还原的元素是 (填元素名称);氧化产物是 (填化学式)
 。
。
(3)若反应消耗了3.2g Cu,则转移电子数 ,被还原的硫酸物质的量为 mol。
(4)将(2)中反应后所得到的溶液稀释后与足量BaCl2溶液反应,写出此过程发生反应的离子方程式  。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com