
分析 (1)根据周期表中个周期元素的种数:2、8、8、18、18、32、32、50、50的递变规律来回答;
(2)原子核外出现第一个6f电子的元素的原子外围电子排布是6f77s2;
(3)根据零族元素的原子序数结合元素周期表的结构来确定元素的位置.
解答 解:(1)周期表中个周期元素的种数:2、8、8、18、18、32、32、50、50的递变规律排列的,所以第8周期共有50种元素,
故答案为:50;
(2)原子核外出现第一个6f电子的元素的原子外围电子排布是6f77s2,根据核外电子排布式,应该是:[118]5g186f18s2,属于139号元素,
故答案为:139;
(3)根据零族元素第七周期最后一个的原子序数是118,所以114号元素在此元素的左边,应该是第七周期,ⅣA族元素,属于p区元素,价电子排布是:7S27p2,
故答案为:七;ⅣA;7S27p2.
点评 本题考查了电子排布规律、元素周期表,是对物质结构化学知识的考查,侧重对基础知识的综合应用的考查,较好的考查学生分析推理能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 珍珠上的污渍可以用酒精擦除,并用软布擦干后用脱脂棉包好保存 | |
| B. | 珊瑚、玛瑙和珍珠一样都可以作为重要药材 | |
| C. | 红宝石可以用于激光器,还可用于制作红宝石轴承 | |
| D. | 蓝宝石中含有变价元素铁、钛等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 步骤 | 操作 | 现象 |
| I | 向2mL 1mol•L-1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色, 并有少量刺激性气味的气体逸出 |
| 1Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3; 2墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色. |
| 步骤 | 操作 | 现象 |
| II | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
| 步骤 | 操作 | 现象 |
| III | 向1mol•L-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| IV | 用激光笔照射步骤III中的红褐色溶液 | 没有出现“丁达尔效应” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阴极的阳极保护法 | |
| B. | 石油的分馏、煤的液化、汽化都是物理变化 | |
| C. | 干馏煤可以得到甲烷、苯和氨等重要化工原料 | |
| D. | 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可以发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
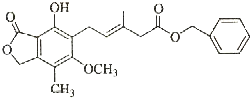
| A. | 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应 | |
| B. | 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 | |
| C. | 可以催化加氢,1mol该物质最多可与7mol H2反应 | |
| D. | 该化合物有4种官能团,可以使酸性KMnO4溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com