
| A、由X、Z、W组成盐的水溶液呈酸性,则溶液中该盐阳离子浓度小于酸根离子浓度 |
| B、气态氢化物的稳定性:W<R<Z |
| C、原子半径:W<Z<Y,而简单离子半径:Y<Z<W |
| D、ZR2、TR2两化合物中R的化合价相同 |


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 以下表及图中分别表示物质间的从属关系,其中不正确的是( )
以下表及图中分别表示物质间的从属关系,其中不正确的是( )| X | Y | Z | H | |
| A | 分散系 | 胶体 | 溶液 | 烟 |
| B | 电解质 | 酸 | 碱 | 含氧酸 |
| C | 氧化物 | 酸性氧化物 | 碱性氧化物 | 非金属氧化物 |
| D | 元素周期表的纵列 | 主族 | 副族 | 卤族 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子核内没有中子 |
| B、M层有5个电子 |
| C、原子核外最外层电子数=电子层数 |
| D、N层上电子数与K层电子数相等,次外层有8个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①、②、③、⑤、⑥ |
| B、②、③、⑤、⑥ |
| C、②、③、⑤、⑥、⑦ |
| D、②、③、④、⑥、⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 常用于制备药物和合成高分子材料.(1)化合物Ⅰ的分子式为
常用于制备药物和合成高分子材料.(1)化合物Ⅰ的分子式为
 +CH3COOH→
+CH3COOH→ .聚合物可用于制备
.聚合物可用于制备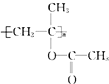
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-=CO32-+NH3↑+2 H2O |
| B、向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -=2 Al(OH)3↓+3BaSO4↓ |
| C、向FeBr2溶液中通入足量氯气:2Fe2++Cl2=2 Fe3++2 Cl- |
| D、醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com