
| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 4.1×106 | 1.847 | 0.507 | 0.152 |
| A、常温下,大气固氮很难进行,而工业固氮却容易进行 |
| B、模拟大气固氮应用于工业上的意义不大 |
| C、工业固氮时,温度越低时其K越大,所以温度越低反应速率越快 |
| D、大气固氮、工业固氮的反应都是放热反应 |


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
| A、标准状况下,22.4 L H2和O2的混合气体中所含的分子数为NA |
| B、6.8g熔融的KHSO4中含有0.05NA个阳离子 |
| C、21.6 g X单质与Cl2完全反应,生成106.8 g XC13.,则X的相对原子质量为27g/mol |
| D、0.1molNa2O2晶体中含有0.1NA个阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、至少存在5种离子 |
| B、Cl-一定存在,且c(Cl?)≥0.4 mol/L |
| C、SO42-、NH4+一定存在,Cl-可能不存在 |
| D、CO32-、Al3+一定不存在,K+可能存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验内容 | 实验目的 |
| A | 向某溶液中加入稀H2SO4,将产生的气体通入澄清石灰水 | 检验溶液中是否含有CO32- |
| B | 向沸水中滴加几滴FeCl3饱和溶液,继续加热至液体呈红褐色 | 制备Fe(OH)3胶体 |
| C | 相同温度下,测定浓度均为0.1mol?L-1的Na2CO3和CH3COONa溶液的pH | 比较CH3COO-和CO32-结合H+的能力强弱 |
| D | 将AlCl3溶液蒸干灼烧 | 制备Al2O3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Na+、NO3-、MnO4- |
| B、Fe3+、H+、I-、HCO3- |
| C、NH4+、Ag+、PO43-、Cl- |
| D、Al3+、Mg2+、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、方程式②中,每生成1mol H2转移2 mol电子 |
| B、①和②两个反应都是氧化还原反应 |
| C、氨基钠和氢化钠与盐酸反应都只生成一种盐 |
| D、氨基钠和氢化钠晶体中都有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
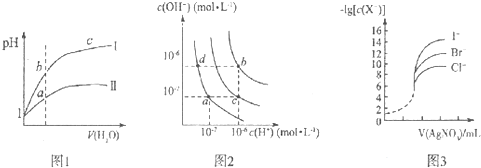
| A、图l表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 |
| B、图2中纯水仅升高温度,就可以从a点变到c点 |
| C、图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性 |
| D、用0.0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000 mol?L-1 Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com