
(15分)(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第 周期.第 族;PbO2的酸性比CO2的酸性 (填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为 。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为 ;PbO2也可以通过石墨为电极,Pb(NO3)2 和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生反应的电极反应式为 ,阴极上观察到的现象是 ;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为 ,这样做的主要缺点是 。
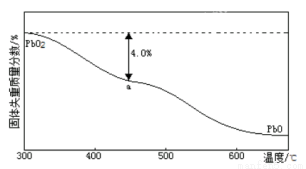
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重的4.0%(即样品起始质量—a点固体质量/样品起始质量×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2 ·nPbO,列式计算x值和m:n值 。
(1)六 ⅣA 弱
(2)PbO2+4HCl(浓) △PbCl2+Cl2↑+2H2O
(3)PbO+ClO- PbO2+Cl- Pb2++2H2O—2e-
PbO2+Cl- Pb2++2H2O—2e- PbO2↓+4H+
PbO2↓+4H+
石墨上包上铜镀层 Pb2++2e- Pb↓ 不能有效利用Pb2+
Pb↓ 不能有效利用Pb2+
(4)根据PbO2 △PbOx+(2—x/2)O2↑,有(2—x/2)×32=239×4.0%,x=2—(239×4.0%/16)=1.4,根据mPbO2 ·nPbO,2m+n/m+n=1.4,m:n=2/3。
【解析】
试题分析:(1)根据题给信息知,铅是碳的同族元素,比碳多4个电子层,碳位于第二周期,则铅在元素周期表的位置为第六周期、第ⅣA族;根据同主族元素性质递变规律判断,PbO2的酸性比CO2的酸性弱。(2)根据题意知,PbO2与浓盐酸共热生成黄绿色气体氯气,迁移二氧化锰与浓盐酸的反应知,反应的化学方程式为PbO2+4HCl(浓) △PbCl2+Cl2↑+2H2O。(3)根据题给信息知,PbO与次氯酸钠溶液反应生成PbO2和氯化钠,反应的离子方程式为PbO+ClO- PbO2+Cl-;根据题给信息知,电解池阳极发生氧化反应,即Pb2+失电子被氧化生成PbO2,电极反应式为Pb2++2H2O—2e-
PbO2+Cl-;根据题给信息知,电解池阳极发生氧化反应,即Pb2+失电子被氧化生成PbO2,电极反应式为Pb2++2H2O—2e- PbO2↓+4H+,阴极上发生还原反应,电极反应式为:Cu2++2e-
PbO2↓+4H+,阴极上发生还原反应,电极反应式为:Cu2++2e- Cu↓,观察到的现象是石墨上包上铜镀层;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为Pb2++2e-
Cu↓,观察到的现象是石墨上包上铜镀层;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为Pb2++2e- Pb↓,这样做的主要缺点是不能有效利用Pb2+。(4)根据题给信息知,PbO2在加热过程发生的反应为PbO2 △PbOx+(2—x/2)O2↑,则有(2—x/2)×32=239×4.0%,x=2—(239×4.0%/16)=1.4,根据mPbO2 ·nPbO,2m+n/m+n=1.4,m:n=2/3。
Pb↓,这样做的主要缺点是不能有效利用Pb2+。(4)根据题给信息知,PbO2在加热过程发生的反应为PbO2 △PbOx+(2—x/2)O2↑,则有(2—x/2)×32=239×4.0%,x=2—(239×4.0%/16)=1.4,根据mPbO2 ·nPbO,2m+n/m+n=1.4,m:n=2/3。
考点:考查元素周期表、元素周期律,根据信息书写方程式,电解原理的应用,与化学反应相关的图像及计算。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(重庆卷解析版) 题型:选择题
下列物质的使用不涉及化学变化的是
A.明矾用作净水剂 B.液氨用作制冷剂
C.氢氟酸刻蚀玻璃 D.生石灰作干燥剂
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(浙江卷解析版) 题型:选择题
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是
| X | Y |
|
W |
|
| Z |
T |
|
|
|
A.X、Y、Z三种元素最低价氢化物的沸点依次升高
B.由X、Y和氢三种元素形成的化合物中只有共价键
C.物质WY2、W3X4、WZ4均有熔点高、硬度大的特性
D.T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(江苏卷解析版) 题型:选择题
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是
组别 | 甲 | 乙 | 丙 |
A | Al | HCl | NaOH |
B | NH3 | O2 | HNO3 |
C | SiO2 | NaOH | HF |
D | SO2 | Ca(OH)2 | NaHCO3 |
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(江苏卷解析版) 题型:选择题
水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图像,模型如图。下列关于水的说法正确的是

A.水是弱电解质 B.可燃冰是可以燃烧的水
C.氢氧两种元素只能组成水 D.0℃时冰的密度比液态水的密度大
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(新课标I卷解析版) 题型:实验题
(15分)乙醇是重要的有机化工原料,可由乙烯直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H)。再水解生成乙醇。写出相应的反应的化学方程式
(2)已知:
甲醇脱水反应①2CH3OH(g)=CH3OCH3(g)+H2O(g)?△H1=-23.9KJ·mol-1
甲醇制烯烃反应②2CH3OH(g)=C2H4 (g)+2H2O(g)? △H2=-29.1KJ·mol-1
乙醇异构化反应③CH3CH2OH(g)=CH3OCH3(g))? △H3=+50.7KJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的?△H= KJ·mol-1
与间接水合法相比,气相直接水合法的优点是: 。
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中n(H2O)︰n(C2H4)=1︰1)
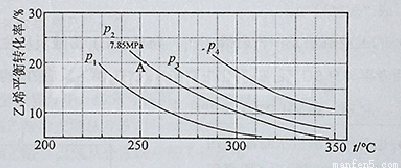
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数K= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②图中压强P1、P2、P3、P4的大小顺序为: ,理由是:
③气相直接水合法党采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃,压强6.9MPa,n(H2O)︰n(C2H4)=0.6︰1。乙烯的转化率为5℅。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有: 、 。
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(广东卷解析版) 题型:选择题
某同学组装了如图所示的电化学装置电极I为Al,其他电极均为Cu,则

A.电流方向:电极IV→ →电极I
→电极I
B.电极I发生还原反应
C.电极II逐渐溶解
D.电极III的电极反应:Cu2++2e-==Cu
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(四川卷解析版) 题型:实验题
(13分)硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
I.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水。其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品中常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
Ⅱ.[制备产品]
实验装置如图所示(省略夹持装置)
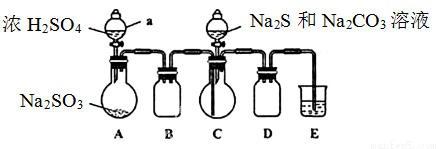
实验步骤:
(1)检查装置气密性,按图示加入试剂。仪器a的名称是____;E中的试剂是___(选填下列字母编号)。
A.稀H2SO4 B.NaOH溶液 C.饱和NaHSO3溶液
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合液,滤液经____(填写操作名称)、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.[探究与反思]
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_____,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原有实验步骤(2)进行了改进,改进后的操作是_______。
(3)Na2S2O3·5H2O的溶解度随温度升高显著增大,所得产品通过_____方法提纯。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com