
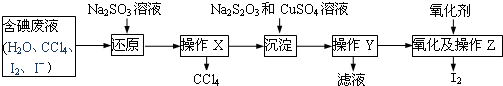
分析 Ⅰ、碘离子具有还原性,能被氧化剂氧化生成碘,碘酸根离子具有氧化性,能被还原剂还原生成碘,碘遇淀粉试液变蓝色,所以其检验方法为:从水层取少量溶液,加入1-2mL淀粉溶液,加入盐酸酸化,滴加FeCl3溶液,2I-+2Fe3+=2Fe2++I2,若溶液变蓝色,说明废水中含有I-,否则不含I-;另从水层取少量溶液,加入1-2mL淀粉试液,加盐酸酸化,滴加Na2SO3溶液,发生5SO32-+2IO3-+2H+=I2+5SO42-+H2O,若溶液变蓝色,说明废水中含有IO3-,否则不含IO3-;
Ⅱ、(2)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,四氯化碳属于有机物,水属于无机物,二者不互溶,分离互不相溶的液体采用分液的方法分离,所以分离出四氯化碳采用分液的方法;
(3)2S2O32-+2Cu2++2I-=2CuI+S4O62-,结合碘元素守恒和化学方程式中定量关系计算得到;
(4)本实验氧化和升华是同时进行的,过氧化氢受热易分解.
解答 解:Ⅰ、碘离子具有还原性,能被氧化剂氧化生成碘,碘酸根离子具有氧化性,能被还原剂还原生成碘,碘遇淀粉试液变蓝色,所以其检验方法为从水层取少量溶液,加入1-2mL淀粉溶液,加入盐酸酸化,滴加FeCl3溶液,2I-+2Fe3+=2Fe2++I2,若溶液变蓝色,说明废水中含有I-,否则不含I-;另从水层取少量溶液,加入1-2mL淀粉试液,加盐酸酸化,滴加Na2SO3溶液,5SO32-+2IO3-+2H+=I2+5SO42-+H2O,若溶液变蓝色,说明废水中含有IO3-,否则不含IO3-,
故答案为:I-;2Fe3++2I-=2Fe2++I2;除去I2的水层溶液少许,加入1~2mL淀粉溶液,加盐酸酸化,滴加亚硫酸钠溶液,溶液不变蓝;
Ⅱ、(2)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为SO32-+I2+H2O═2H++SO42-+2I-,四氯化碳属于有机物,水属于无机物,二者不互溶,分离互不相溶的液体采用分液的方法分离,所以分离出四氯化碳采用分液的方法;
故答案为:四氯化碳中的碘进入水层;分液;
(3)已知该含碘废液中碘元素的含量为10.33g/L,若回收500mL该含碘废液中的碘,含碘元素质量=0.5L×10.33g/L=5.165g,物质的量=$\frac{5.165g}{127g/mol}$=0.0406692mol,
2S2O32-+2Cu2++2I-=2CuI+S4O62-,依据反应定量关系得到,至少需要2mol/L的硫酸铜溶液体积=$\frac{0.0406692mol}{2mol/L}$=0.203346L≈20.33ml;
故答案为:20.33;
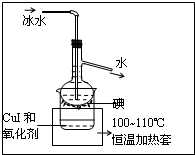
(4)将CuI转移入烧杯中,加入氧化剂在如图2所示的装置中反应,一段时间后在蒸馏烧瓶底得到紫红色固体碘单质,H2O2是一种性能优良的绿色氧化剂可将CuI氧化为I2,本实验不选用H2O2,可能的原因是过氧化氢易分解失去氧化性;
故答案为:本实验氧化和升华是同时进行的,H2O2温度较高时易分解.
点评 本题考查了物质提纯的实验过程分析判断,物质性质和氧化还原反应实质的理解应用,掌握基础是关键,题目难度大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
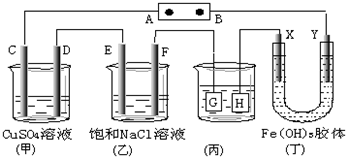
| A. | 若用乙烷、空气燃料电池作电源,电解质为KOH溶液,则B极的电极反应式为:O2+2H2O+4e-═4OH- | |
| B. | 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| C. | (丁)装置中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷 | |
| D. | C、D、E、F电极均有单质生成,其物质的量比为1:1:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH值均为12的氨水和氢氧化钠溶液各10 mL,分别加水稀释至100 mL,氨水溶液的PH值变化较大 | |
| B. | 将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化 | |
| C. | FeI2的溶液中,缓慢通入少量氯气,再滴加少量CCl4,振荡,静置,下层液体为紫色 | |
| D. | 量筒、滴定管、容量瓶都可以用来量取液体,量筒、滴定管都有“0”刻度,量筒“0”刻度在下面,滴定管“0”刻度在上面,容量瓶有标线无其它刻度,滴定管和容量瓶使用前都需要检查是否漏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用草酸钠标定高锰酸钾溶液的实验中,滴定终点的判断为:当滴入最后一滴高锰酸钾溶液时,溶液由无色变为浅紫色,且半分钟内不褪色 | |
| B. | 探究“影响硫代硫酸钠与稀硫酸反应速率的因素”的实验中,需要用到的计量仪器只需量筒、温度计 | |
| C. | 在溴富集过程中,可在分液漏斗中加入1mL溴水,再向其中加入3mL四氯化碳,振荡,静置、分液,得下层液体 | |
| D. | 在两支试管中分别加1ml无水乙醇和1.5g苯酚固体,再加等量等体积的钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
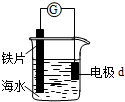
| A. | d为石墨,电流从d流入导线进入铁片 | |
| B. | d为铜片,铜片上电极反应为:O2+2H2O+4e-═4OH- | |
| C. | d为锌块,铁片不易被腐蚀 | |
| D. | d为镁片,铁片上电极反应为:2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸 | B. | 氨水 | C. | AgNO3 溶液 | D. | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由H+(aq)+OH- (aq)═H2O(l);△H=-57.3 kJ•mol-1:可知含1 mol氢氧化钡的溶液与含0.5 mol硫酸的稀溶液混合,放出热量大于57.3 kJ | |
| B. | 由H2O(g)═H2O(l)△H=-44.0kJ•mol-1可知是放热反应 | |
| C. | 由SO2(g)+0.5O2(g)═SO3(g)△H=-98.3 kJ•mol-1可知,在密闭容器中充入2 mol SO2和1 mol O2充分反应后,放出热量为196.6 kJ | |
| D. | 由△G=△H-T△S可知,所有放热反应都能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据如图所示装置回答:
根据如图所示装置回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com