
【题目】在高温高压下CO具有极高的化学活性,能与多种单质或化合物反应.
(1)若在恒温恒容的容器内进行反应C(s)+H2O(g)CO(g)+H2(g),则可用来判断该反应达到平衡状态的标志有 . (填字母)
a.容器内的压强保持不变
b.容器中H2浓度与CO浓度相等
c.容器中混合气体的密度保持不变
d.CO的生成速率与H2的生成速率相等
(2)CO一空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2 . 该电池负极的电极反应式为 .
(3)一定条件下,CO与H2可合成甲烷,反应方程式为:CO(g)+3H2(g)CH4(g)+H2O(g)
①一定条件下,该反应能够自发进行的原因是 .
②已知H2(g)、CO(g)和 CH4(g)的燃烧热分别为285.8kJmol﹣1、283.0kJmol﹣1和890,0kJmol﹣1 .
写出CO与H2反应生成CH4和CO2的热化学方程式:
(4)工业上可通过甲醇羰基化法制取甲酸甲酯,反应方程式为:CH3OH(g)+CO(g) ![]() HCOOCH3(g)△H=﹣29.1kJmol﹣1 . 科研人员对该反应进行了研究.部分研究结果如图所示:
HCOOCH3(g)△H=﹣29.1kJmol﹣1 . 科研人员对该反应进行了研究.部分研究结果如图所示: 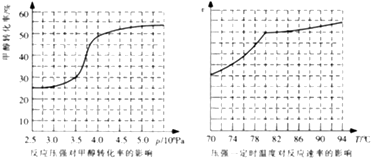
①从反应压强对甲醇转化率的影响“效率“看,工业制取甲酸甲酯应选择的压强是 .
②实际工业生产中采用的温度是80℃,其理由是 .
【答案】
(1)ac
(2)CO﹣2e一+O2一=CO2
(3)该反应△H<0;2CO(g)+2H2(g)?CH4(g)+C02(g)△H=﹣247.6 kJ?mol﹣1
(4)3.5×106 Pa~4.0×106Pa;高于80℃时,温度对反应速率影响较小;且反应放热,升高温度时平衡逆向移动,转化率降低
【解析】解:(1)在恒温恒容的容器内进行反应C(s)+H2O(g)CO(g)+H2(g),
a.反应前后气体压强变化的反应,容器内的压强保持不变,说明反应达到平衡,故a正确;
b.容器中H2浓度与CO浓度相等不一定达到平衡,故b错误;
c.反应中有固体碳反应,平衡变化,气体质量发生变化,容器中混合气体的密度保持不变,能说明反应达到平衡,故c正确;
d.CO的生成速率与H2的生成速率相等,证明反应正向进行,故d错误;
所以答案是:ac; (2)CO一空气燃料电池,一氧化碳在负极失电子发生氧化反应,电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2 . 该电池负极的电极反应式为:CO﹣2e﹣+O2﹣=CO2 ,
所以答案是:CO﹣2e﹣+O2﹣=CO2; (3)①CO(g)+3H2(g)CH4(g)+H2O(g),反应△S<0,依据自发进行的判断依据△H﹣T△S<0,所以△H<0,所以答案是:该反应△H<0;②H2(g)、CO(g)和 CH4(g)的燃烧热分别为285.8kJmol﹣1、283.0kJmol﹣1和890,0kJmol﹣1 .
a、H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.8kJmol﹣1
O2(g)=H2O(l)△H=﹣285.8kJmol﹣1
b、CO(g)+ ![]() O2(g)=CO2 (g)△H=﹣283.0kJmol﹣1
O2(g)=CO2 (g)△H=﹣283.0kJmol﹣1
c、CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890,0kJmol﹣1
依据盖斯定律(b+a)×2﹣c得到2CO(g)+2H2(g)CH4(g)+C02(g)△H=﹣247.6 kJmol﹣1
所以答案是:2CO(g)+2H2(g)CH4(g)+C02(g)△H=﹣247.6 kJmol﹣1;(4)①从反应压强对甲醇转化率的影响“效率“看,图象中转化率变化最大的是3.5×106 Pa~4.0×106Pa,
所以答案是:3.5×106 Pa~4.0×106Pa;②依据图象分析温度在高于80°C对反应速率影响不大,反应是放热反应,温度过高,平衡逆向进行,不利于转化率增大,
所以答案是:高于80℃时,温度对反应速率影响较小;且反应放热,升高温度时平衡逆向移动,转化率降低.
【考点精析】本题主要考查了化学平衡状态的判断的相关知识点,需要掌握状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等才能正确解答此题.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验的叙述正确的是
A.过滤时,可用玻璃棒搅拌漏斗中的液体以加快过滤速率
B.用湿润的pH试纸测溶液的pH,因溶液被稀释而使测量值变大
C.酸碱滴定管、容量瓶、分液漏斗使用前必须检查是否漏水
D.酸碱滴定实验中,需用待滴定溶液润洗锥形瓶以减小实验误差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.碘化亚铜(Cu2I2)是一种不溶于水也不溶于酸的白色固体,用途很广泛。完成下列填空:
(1)碘化钾溶液中滴加适量硫酸铜溶液,就能得到碘化亚铜。写出该反应的化学方程式: _________。
(2)往上述反应后溶液中加入淀粉,溶液变蓝,再滴加亚硫酸溶液,蓝色又褪去。写出KI、Cu2I2、H2SO3的还原性由强到弱的顺序是______________。
(3)碘化亚铜能用于检测空气中的汞蒸气,其反应为2Cu2I2+Hg===Cu2HgI4(玫瑰红)+ 2Cu,产物Cu2HgI4中Cu元素显_______价,当有1 mol Cu2I2参与反应时,转移电子数目______。
Ⅱ、过氧化钙可以用于改善地表水质,为测定过氧化钙产品中CaO2的含量,进行如下的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
(已知:I2+2S2O32-=2I-+S4O62-)
(4)第一步发生反应的化学方程式为______________________________;
(5)样品中CaO2的质量分数为____________(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法正确的是
A. 还原剂中必定有一种元素被氧化
B. 在氧化还原反应中,失去电子的元素化合价降低
C. 物质中某元素失去电子,则此物质是氧化剂
D. 物质所含元素化合价升高的反应叫还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,已知反应N2(g)+3H2(g)2NH3(g)△H=﹣92.3kJmol﹣1 , 平衡常数K=4.下列说法正确的是( )
A.使用催化剂会使K变化但△H不变
B.使用催化剂会使△H增大,但K不变
C.使用催化剂和提高温度均可增大H2的转化率
D.在一密闭容器中,投入浓度均为1molL﹣1的 N2、H2、NH3 , 平衡前v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.摩尔是用于计量微观粒子集体的物理量
B.CO2的摩尔质量为44g
C.0.5mol水中约含6.02×1023个H
D.标准状况下1 mol任何物质体积均为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源.制氢和储氢作为氢能利用的关键技术,是当前科学家主要关注的热点问题.
(1)用甲烷制取氢气的两步反应的能量变化如图所示: 
①甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是 .
②第Ⅱ步反应为可逆反应.800℃时,若CO的起始浓度为2.0molL﹣1 , 水蒸气的起始浓度为3.0molL﹣1 , 达到化学平衡状态后,测得CO2的浓度为1.2molL﹣1 , 则CO的平衡转化率为 .
(2)NaBH4是一种重要的储氢载体,能与水反应生成NaBO2 , 且反应前后B元素的化合价不变,该反应的化学方程式为 , 反应消耗1mol NaBH4时转移的电子数目为 .
(3)储氢还可借助有机物,如利用环已烷和苯之间的可逆反应来实现脱氢和加氢. 
在某温度下,向恒容容器中加入环已烷,其起始浓度为a molL﹣1 , 平衡时苯的浓度为b molL﹣1 , 该反应的平衡常数K=(用含a、b的关系式表达).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关胶体的认识不正确的是( )
A. FeCl3饱和溶液滴入沸水可制得胶体 B. 胶体粒子直径在1~100 nm之间
C. 胶体粒子可以透过滤纸 D. 是否有丁达尔现象是胶体和溶液的本质区别
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com