
北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C60形成的球碳盐K3C60。实验测知该物质属于离子晶体,具有良好的超导性。下列关于K3C60的组成和结构分析正确的是
A. K3C60中既有离子键又有极性键 B.1mol K3C60中含有的离子数目为63×6.02×1023
C.该晶体在熔融状态下能导电 D.该物质的化学式可写作KC20
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
如图所示,X、Y、Q、W 都是惰性电极,将电源接通后,W 极附近颜色逐渐加深。下列说法中不正确的是( )

A、电源的 M 极为正极
B、甲装置中溶液的 pH 减小
C、甲装置的两个电极上都有单质生成且物质的量之比为1:1
D、欲用乙装置给铜镀银,U 极应该是 Ag,电镀液选择 AgNO3 溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
每组中都有一种物质与其他物质在分类上不同,试分析每组中物质的组成规律,将这种不同于其他物质的物质找出来。
(1)NaCl、KCl、NaClO、BaCl2____________。
(2)HClO3、KClO3、Cl2、NaClO3______________。
(3)H3PO4、H4SiO4、HCl、H2SO4____________。
(4)浊液、溶液、胶体、水____________。
(5)空气、N2、HCl气体、CO2、CuSO4·5H2O_____________________。
(6)铜、金、银、钠____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素的原子结构决定其性质和在周期表中的位置,下列说法正确的是
A.元素原子的最外层电子数一定等于元素的最高化合价
B.多电子原子中,在离核较近的区域内运动的电子能量较高
C.P、S、Cl 得电子能力和最高价氧化物水化物的酸性均依次增强
D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z三种元素原子的核电荷数在10~18之间,它们的最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4。则下列判断正确的是
A.元素电负性:按X、Y、Z变小
B.含氧酸的酸性:H3ZO4>H2YO4>HXO4
C.气态氢化物稳定性:按X、Y、Z顺序增加
D.非金属性:X<Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
aXn-和bYm+是由短周期元素形成的简单离子,已知Xn-比Ym+多两个电子层,下列说法正确的是( )
A.X只能是第三周期元素 B.Y不可能是第二周期元素
C.b≤4 D.a-b+m+n等于10或20
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D、E、F六种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7:8;E与B的质量比为1:1。F+离子的3d轨道中电子全充满。回答下列问题:
(1)写出基态E原子的电子排布式──────────────── 。
(2)用电子式表示AE2的形成过程 。
(3)B、C两元素的第一电离能大小关系为:───>────(填写元素符号),原因是 。
(4)B元素的最低价氢化物分子立体构型为 。中心原子的杂化方式为 。
(5)向F2+离子的溶液中加入过量CH3的浓溶液,充分反应后溶液呈深蓝色,该反应的离子方程式是__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业制ClO2的化学反应:2NaClO3 + SO2 + H2SO4=2ClO2 + 2NaHSO4,下列说法正确的是
A.NaClO3在反应中化合价降低,失去电子
B.SO2在反应中发生氧化反应
C.1 mol氧化剂在反应中得到2 mol电子
D.H2SO4 在反应中作氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应的体系;当在某一温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二。
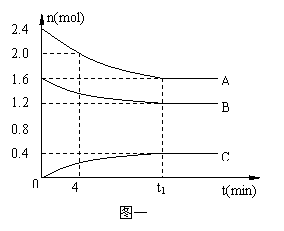 | |||
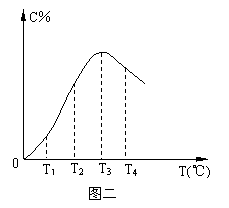 | |||
下列分析不正确的是:
A.0~4分钟时,A的平均反应速率为0.02mol/(L?min)
B.该反应的平衡常数表达式K=
C.由T1向T2变化时,正反应速率大于逆反应速率
D.此反应的正反应为放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com