
在密闭容器中,aA(气)⇌bB(气)达平衡后,保持温度不变,将容器体积增加1倍,当达到新平衡时,B的浓度是原来的60%,下列说法正确的是( )
|
| A. | 平衡向逆反应方向移动了 | B. | 物质A的转化率减少了 |
|
| C. | 物质B的质量分数增加了 | D. | a>b |
考点:
化学平衡的影响因素.
专题:
化学平衡专题.
分析:
若a=b,则保持温度不变,将容器体积增加一倍,平衡不移动,B和C的浓度应均是原来的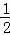 ,但当达到新的平衡时,B的浓度均是原来的60%,说明减小压强平衡向正反应方向移动,则说明a<b,以此来分析.
,但当达到新的平衡时,B的浓度均是原来的60%,说明减小压强平衡向正反应方向移动,则说明a<b,以此来分析.
解答:
解:若a=b,则保持温度不变,将容器体积增加一倍,平衡不移动,B和C的浓度应均是原来的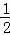 ,但当达到新的平衡时,B的浓度均是原来的60%,说明减小压强平衡向正反应方向移动,则说明a<b.
,但当达到新的平衡时,B的浓度均是原来的60%,说明减小压强平衡向正反应方向移动,则说明a<b.
A、由以上分析可知,平衡应向正反应方向移动,故A错误;
B、平衡应向正反应方向移动,A的转化率增大,故B错误;
C、平衡应向正反应方向移动,物质B的质量分数增加了,故C正确
D、增大压强平衡向逆反应方向移动,则说明a<b,故D错误.
故选C.
点评:
本题考查化学平衡移动问题,题目难度不大,注意通过改变体积浓度的变化判断平衡移动的方向,此为解答该题的关键.


科目:高中化学 来源: 题型:
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) Z(g)+W(s):△H>0下列叙述正确的是
Z(g)+W(s):△H>0下列叙述正确的是
A、加入少量W,逆反应速率增大 B、当容器中气体压强不变时,反应达到平衡
C、升高温度,平衡逆向移动 D、平衡后加入X,上述反应的△H增大
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合后(忽略混合前后溶液体积的变化),溶液的pH<7,则下列有关此溶液的叙述正确的是( )
A.溶液中由水电离产生的H+浓度为1×10-7 mol/L
B.c(CH3COO-)+c(CH3COOH)-c(Na+)=0.05 mol/L
C.溶液中CH3COOH的电离程度小于CH3COONa的水解程度
D.溶液中离子浓度的大小关系为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列操作中,能使电离平衡H2O⇌H++OH﹣,向右移动且溶液呈酸性的是( )
|
| A. | 向水中加入NaHSO4溶液 | B. | 向水中加入Al2(SO4)3溶液 |
|
| C. | 向水中加入NaOH溶液 | D. | 将水加热到100℃,使pH=6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:CH3CH2CH2CH3(g)+6.5O2(g)═4CO2(g)+5H2O(l)△H=﹣2878kJ•mol﹣1,(CH3)2CHCH3(g)+6.5O2(g)═4CO2(g)+5H2O(l)△H=﹣2869kJ•mol﹣1下列说法正确的是( )
|
| A. | 正丁烷分子储存的能量大于异丁烷分子 |
|
| B. | 正丁烷的稳定性大于异丁烷 |
|
| C. | 异丁烷转化为正丁烷的过程是一个放热过程 |
|
| D. | 异丁烷分子中的碳氢键比正丁烷的多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
请将下列物质的序号按要求填空:①石墨②铁钉③氧化钠④二氧化硫⑤水⑥盐酸⑦硫酸⑧氢氧化钙⑨氟化钠⑩甲烷,其中属于电解质的是 ,属于非电解质的是 ,属于强电解质的是 ,属于弱电解质的是 .写出③的电子式: ,⑩的结构式 ,⑨的水溶液显 (填“酸性”、“碱性”、“中性”),用离子方程式解释 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列属于正确的水解离子方程式的是( )
|
| A. | NH4++H2O⇌NH3•H2O+H+ | B. | H2O+H2O⇌H3O++OH﹣ |
|
| C. | CO32﹣+2H2O⇌H2CO3+2OH﹣ | D. | Fe3++3H2O⇌Fe(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应aA(g)+bB(g)⇌cC(g)+dD(g)△H,同时符合下列两图中各曲线的规律是( )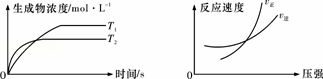
|
| A. | a+b>c+d T1>T2 △H>0 | B. | a+b>c+d T1<T2 △H<0 |
|
| C. | a+b<c+d T1>T2 △H>0 | D. | a+b<c+d T1<T2 △H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:还原性HSO3﹣>I﹣,氧化性IO3﹣>I2.在含0.3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是()
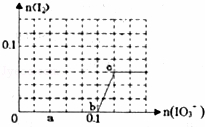
A. 0~b间的反应可用如下离子方程式表示:3HSO3﹣+IO3﹣═3SO42﹣+I﹣+3H+
B. a点时消耗NaHSO3的物质的量为0.12mol
C. 当溶液中I﹣与I2的物质的量之比为5:2时,加入的KIO3为0.18mol
D. b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com