
 下列实验问题的处理方法中,正确的是
下列实验问题的处理方法中,正确的是
|
| A. | 实验中不慎打破温度计,可用吹风机加快水银的蒸发 |
|
| B. | 在气体发生装置上直接点燃甲烷气体时,必须先检验甲烷的纯度 |
|
| C. | 实验结束后,将废液倒入下水道排出实验室,以免污染实验室 |
|
| D. | 燃着的酒精灯不慎碰翻失火,应立即用水扑灭 |
科目:高中化学 来源: 题型:
amolFeS与bmolFe3O4投入到VL cmol/L的硝酸溶液中恰好完全反应,假设只产生NO气体。所得澄清溶液的成分是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸为( )
A.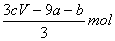 B.(a+3b)mol C.
B.(a+3b)mol C.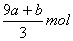 D.(cV-3a-9b)mol
D.(cV-3a-9b)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与日常生活密切相关,下列说法错误的是
A.碘酒是指单质碘的乙醇溶液 B.84消毒液的有效成分是NaClO
C.生石灰用作食品抗氧剂 D.小苏打是面包发酵粉的主要成分
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.某液体物质的摩尔质量大于18g/mol,则该物质密度一定比水大
B.同温同压下,分别将充满HCl、NO2的两支试管倒立于蒸馏水中足够长时间,假设不考虑溶质扩散,两支试管中溶液的物质的量浓度之比为3:2
C.将90 % H2SO4溶液与10 % H2SO4溶液等体积混合,其质量分数一定等于50 %
D.c mol/L KCl溶液的密度为ρg/cm3,则此KCl溶液的质量分数为(74.5c/1000ρ)×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ. 实验室若要配制90mL 1mol·L-1氯化钠溶液,请回答下列问题:
配制过程中需要使用的主要仪器包括烧杯、玻璃棒、胶体滴管、量筒和
用托盘天平称取氯化钠固体,其质量为 g
下列情况对所配制的氯化钠溶液浓度有何影响?(填“偏大”“偏大”或“无影响”)
①定容时,俯视溶液的凹液面 ;
②容量瓶用蒸馏水洗涤后残留有少量的水 。
Ⅱ. 在标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:
混合气体的平均摩尔质量是 ;
混合气体中C、O原子个数比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A. 金属阳离子一定只具有氧化性
B. 金属单质作反应物时一定不是氧化剂
C. 氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原
D. 氧化还原反应中的反应物,不是氧化剂就是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列化学方程式中,能够用离子方程式H+ + OH-= H2O表示的是
A.醋酸溶液与氢氧化钠溶液反应
B.盐酸与氨水反应
C.硫酸氢钠溶液与氢氧化钾溶液反应
D.氢氧化铁与硫酸溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
有AlCl3和NaCl的混合溶液VL,将它均分成两份。一份滴加氨水,使Al3+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗a mol NH3·H2O、b mol AgNO3。据此得知原混合溶液中的c(Na+) (mol/L)为
A. (2b-4a)/V
(2b-4a)/V  B.(b-a)/V C.(2b-2a)/V D.(b-2a)/V
B.(b-a)/V C.(2b-2a)/V D.(b-2a)/V
查看答案和解析>>
科目:高中化学 来源: 题型:
钾水玻璃以其优异的性能广泛用于防腐、铸造、油田、钻井或各种高档涂料中。钾水玻璃中硅含量的测定可以采用氟硅酸钾容量法,其步骤为:
①称取试样溶解在含有过量的氟离子和钾离子的强酸溶液中,硅能与氟离子、钾离子作用生成氟硅酸钾(K2SiF6)沉淀;
②沉淀分离后于热水中水解,生成HF、H2SiO3、KF;
③过滤除去硅酸沉淀,用氢氧化钠标准溶液滴定滤液。
(1)上述步骤②中的水解反应方程式为 ▲ ;
步骤③中反应的离子方程式为: ▲ 。
(2)在步骤③中,若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得的硅元素含量将
▲ (填“偏高”、或“偏低”或“不变”)。
(3)若每次称取试样的质量为1.00g,重复滴定四次,消耗1.00 mol·L-1氢氧化钠标准溶液的体积为分别为16.80mL、19.90mL、20.00mL、20.10mL,试计算该试样中硅元素的质量分数(以二氧化硅计),写出计算过程。 ▲
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com