
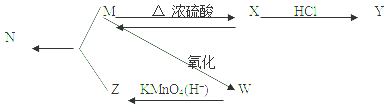
 $→_{△}^{浓硫酸}$R-CH=CH2+H2O,叫做消去反应
$→_{△}^{浓硫酸}$R-CH=CH2+H2O,叫做消去反应分析 X是很常见的石油化工的基本原料,也是一种植物生长调节剂,则X是乙烯其结构简式为CH2=CH2,X和HCl发生加成反应生成Y,结构简式为CH3CH2Cl,乙醇发生消去反应生成乙烯,则M结构简式为CH3CH2OH,乙醇被氧化生成乙酸,所以W结构简式为CH3CHO,乙醛被酸性高锰酸钾氧化生成乙酸,则Z结构简式为CH3COOH,乙醇和乙酸在浓硫酸作催化剂、加热条件下发生酯化反应生成乙酸乙酯,所以N结构简式为CH3COOCH2CH3,据此分析解答.
解答 解:(1)通过以上分析知,X、Y、Z的结构简式分别是乙醇CH3CH2OH、CH3CH2Cl、CH3COOH,故答案为:CH2=CH2;CH3CH2Cl;CH3COOH;
(2)M→X是乙醇发生消去反应生成乙烯,反应方程式为CH3CH2OH$→_{△}^{浓硫酸}$ CH2=CH2↑+H2O,该反应为消去反应,
M→W为乙醇的催化氧化反应,生成乙醛,反应方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,该反应为氧化反应,
X→M为乙烯与水发生的加成反应,生成乙醇,反应方程式为CH2=CH2+H2O$\stackrel{催化剂}{→}$ CH3CH2OH,该反应为加成反应,
M→N为乙酸与乙醇发生酯化反应生成F为CH3COOC2H5,方程式为CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,该反应为酯化反应;
故答案为:CH3CH2OH$→_{△}^{浓硫酸}$ CH2=CH2↑+H2O,消去反应;
2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,氧化反应;
CH2=CH2+H2O$\stackrel{催化剂}{→}$ CH3CH2OH,加成反应;
CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,酯化反应.
点评 本题考查有机物推断,涉及烯、醇、醛、羧酸、卤代烃之间的转化,明确物质官能团及其性质之间的关系即可解答,熟练掌握有机物反应类型,题目难度不大.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 硝是指硝酸钾 | B. | 黑火药爆炸是氧化还原反应 | ||
| C. | 反应放热并产生大量气体 | D. | 木炭在反应中被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
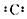 B-的结构示意图
B-的结构示意图 C+的电子式Na+
C+的电子式Na+查看答案和解析>>
科目:高中化学 来源: 题型:解答题
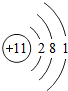 ;铝原子的结构示意图是
;铝原子的结构示意图是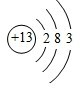 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “碘遇淀粉变蓝色”,“碘”指碘元素 | |
| B. | 为了补碘,要多食用含高碘酸的食物 | |
| C. | 碘水中加入CCl4后,充分混合后静置分层.CCl4在下层,呈现紫红色.如果在太空实验室中混合这两种液体,CCl4就未必在下层 | |
| D. | 通过“取样→灼烧→溶解→过滤→萃取”可从海带中提取单质碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应是吸热反应 | |
| B. | 化学反应中的能量变化只表现为热量变化 | |
| C. | 当反应物的总能量高于生成物的总能量时,通常发生放热反应 | |
| D. | 当反应物的总能量高于生成物的总能量时,通常发生吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com