
| A. | 范德华力 | B. | 共价键 | C. | 氢键 | D. | 离子键 |
分析 在硼酸[B(OH)3]分子中,氧原子与氢原子形成1对共用电子对,氧元素的电负性很强,不同硼酸分子中的氧原子与氢原子之间形成氢键,此外硼酸分子之间存在范德华力,氢键比范德华力更强.
解答 解:在硼酸[B(OH)3]分子中,硼原子最外层只有3个电子,B原子与3个羟基相连,与氧原子形成3对共用电子对,即形成3个σ键,氧原子与氢原子形成1对共用电子对,氧元素的电负性很强,不同硼酸分子中的氧原子与氢原子之间形成氢键,硼酸分子之间存在范德华力,氢键比范德华力更强,故硼酸分子之间主要是氢键,
故选C.
点评 本题考查化学键、氢键等,题目难度中等,注意氢键的形成,由于电负性很大的元素F、O、N与氢原子结合,共用电子对偏离H原子,使H原子几乎成为裸露的质子,而发生电性吸引.


科目:高中化学 来源: 题型:选择题
| A. | 向相同体积,相同pH的两种一元酸中分别加入足量锌粉,测量产生氢气的体积,可以比较两种一元酸的酸性相对较弱 | |
| B. | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至恰好不再有沉淀生成,再向其中滴加Na2S溶液,生成黑色沉淀,说明一种沉淀能转化为另一种溶解度更小的沉淀 | |
| C. | 室温下,用pH试纸测定浓度为0.1mol/LNaClO溶液和0.1mol/LCH3COONa溶液的pH,可以比较HClO和CH3COOH的酸性强弱 | |
| D. | 在滴有酚酞Na2CO3溶液中逐滴加入BaCl2溶液,红色逐渐褪去,说明Na2CO3溶液中存在水解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| I1 | I2 | I3 | I4 | I5 | … | |
| R | 740 | 1500 | 7700 | 10500 | 13600 | … |
| A. | ①③ | B. | ②③ | C. | ②③④ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X<Y | |
| B. | 第一电离能:X>Y | |
| C. | 气态氢化物的稳定性:HmY小于HnY | |
| D. | X与Y形成化合物时,一般显负价,Y显正价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
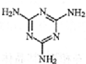 )添加于奶粉中,增加奶粉中的含氮量.下列关于三聚氰胺分子的说法正确的是( )
)添加于奶粉中,增加奶粉中的含氮量.下列关于三聚氰胺分子的说法正确的是( )| A. | 形成的晶体熔点较高 | |
| B. | 一个分子中共含有15个σ键 | |
| C. | 属于极性分子,故极易溶于水 | |
| D. | 所有面原子采用sp2杂化,所有氮原子采用sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com