
| A、3个 | B、4个 | C、5个 | D、6个 |


科目:高中化学 来源: 题型:
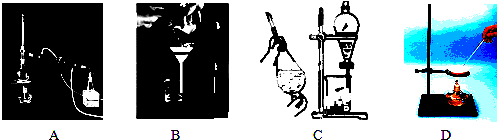
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu2+、K+、OH- |
| B、H+、Ba2+、SO42- |
| C、K+、Na+、Cl- |
| D、Ca2+、Na+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KOH和Na2CO3都属于碱 |
| B、K2CO3和KHCO3都属于盐 |
| C、H2SO4和HNO3都属于酸 |
| D、Na2O和SiO2都属于氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若金属有剩余,在溶液中再滴入硫酸后,金属不再溶解 | ||
| B、若金属全部溶解后,再加入KSCN溶液,则溶液一定呈血红色 | ||
| C、若金属全部溶解,且产生336 mL气体(标准状况),则b=0.3 | ||
D、当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 配料表 | 精制海盐、碘酸钾 |
| 含碘量 | 20~40mg/kg |
| 卫生许可证号 | ××卫碘字(1999)第001号 |
| 分装日期 | 见封底 |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹调时,待食品熟后加入碘盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
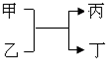 现有甲、乙、丙、丁4种物质,其转化关系如图:
现有甲、乙、丙、丁4种物质,其转化关系如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com