
| A. | 等于4.48L | B. | 小于2.24L | C. | 大于2.24L | D. | 等于2.24L |
分析 铝箔成分是表面为氧化铝的金属铝,氧化铝、金属铝都和强碱溶液反应,其中铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;金属钠放入水中剧烈反应生成氢氧化钠和氢气,铝与氢氧化钠溶液反应生成氢气,导致生成氢气的体积变大,据此进行解答.
解答 解:钠与水反应为:2Na+2H2O=2NaOH+H2↑,4.6g钠的物质的量为:$\frac{4.6g}{23g/mol}$=0.2mol,根据化学方程式得生成氢气0.1mol,标况下的体积为2.24L,
铝箔表面氧化铝是两性氧化物,与氢氧化钠溶液反应,金属铝与氢氧化钠溶液反应也生成氢气,故生成氢气体积大于2.24L,
故选C.
点评 本题考查了物质的量的计算,题目难度不大,明确发生反应的原理为解答关键,注意掌握物质的量与摩尔质量、气体摩尔体积之间的关系,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
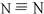 ,氮的氢化物除了氨气,还有一种在常温下呈液态的肼,分子式为N2H4,请写出肼的电子式
,氮的氢化物除了氨气,还有一种在常温下呈液态的肼,分子式为N2H4,请写出肼的电子式 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④ | C. | ②⑤⑥ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
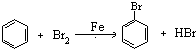 (或
(或 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
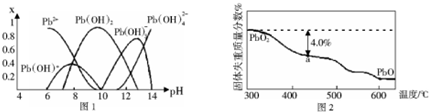
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
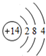 ,写出①的气态氢化物的分子式NH3.
,写出①的气态氢化物的分子式NH3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com