
| 选项 | 气体 | 溶液 | 现象 | 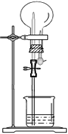 |
| A | NH3 | H2O含酚酞 | 红色喷泉 | |
| B | Cl2 | 饱和食盐水 | 无色喷泉 | |
| C | HCl | H2O含石蕊 | 红色喷泉 | |
| D | SO2 | NaOH溶液 | 无色喷泉 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氨气极易溶于水,且氨水溶液显碱性,酚酞遇碱变红;
B.饱和食盐水中氯离子的浓度达到最大程度,抑制了氯气的溶解,则无法形成喷泉;
C.HCl极易溶于水,且盐酸溶液显酸性,石蕊遇酸变红;
D.二氧化碳易与NaOH溶液反应,反应后溶液为无色.
解答 解:A.因氨气极易溶于水,则挤压胶管的胶头,使烧瓶中的气压减小,且小于外界大气压,则形成喷泉,又氨水溶液显碱性,酚酞遇碱变红,故形成红色喷泉,故A不选;
B.因饱和食盐水抑制氯气的溶解,则挤压胶管的胶头,气压变化不明显,则不会形成喷泉,故B选;
C.因HCl极易溶于水,则挤压胶管的胶头,使烧瓶中的气压减小,且小于外界大气压,则形成喷泉,又盐酸溶液显酸性,石蕊遇碱变红,故形成红色喷泉,故C不选;
D.二氧化碳易与NaOH溶液反应,则挤压胶管的胶头,使烧瓶中的气压减小,且小于外界大气压,则形成喷泉,又反应后的溶液为无色,故形成无色喷泉,故D不选;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构造原理 | B. | 泡利不相容原理 | C. | 洪特规则 | D. | 能量最低原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2在Cl2中燃烧、H2与Cl2的混合气体光照发生爆炸,都放出热量 | |
| B. | H2在O2中燃烧生成H2O放出能量,H2O分解为H2和O2吸收能量 | |
| C. | 氙和氟按一定比例混合,在一定条件下可直接发生反应:Xe+2F2═XeF4,该反应过程中Xe和F2都有化学键断裂 | |
| D. | 在CaO+H2O═Ca(OH)2的过程中CaO和H2O的总能量高于Ca(OH)2的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层电子数:Z>R>Y | |
| B. | 气态氢化物的稳定性:Y>Z | |
| C. | R、X的氧化物均为离子化合物 | |
| D. | Z的氢化物水溶液和Y最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com