
分析 三种离子的氧化能力强弱Fe3+>Cu2+>Fe2+,
(1)若无固体剩余,Fe只能与Fe3+反应生成二价铁,不可能与Cu2+反应生成二价铁和铜单质,结合反应判断;
(2)若有铁粉剩余,Fe3+、Cu2+都与Fe反应,结合反应判断.
解答 解:三种离子的氧化能力强弱Fe3+>Cu2+>Fe2+,
(1)若无固体剩余,Fe只能与Fe3+反应生成二价铁,发生反应:2Fe3++Fe=3Fe2+,不可能与Cu2+反应生成二价铁和铜单质,所以溶液中一定存在的离子有Cu2+、Fe2+,当三价铁过量时,还可能还有Fe3+;故答案为:Cu2+、Fe2+;Fe3+;
(2)若有铁粉剩余,Fe3+、Cu2+都与Fe反应,发生反应:2Fe3++Fe=3Fe2+,Fe+Cu2+=Fe2++Cu,溶液中一定没有Cu2+、Fe3+,一定含有Fe2+,故答案为:Fe2+.
点评 本题考查了Fe3+、Cu2+的氧化能力大小的应用,根据固体的成分了解反应的先后顺序,从而确定溶液的成分,难度不大.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 1L该溶液中含溶质98g | |
| B. | 从10mL 该溶液中取出5mL后,剩余溶液的浓度为0.5mol•L-1 | |
| C. | 将4.9g浓硫酸加入盛有50mL蒸馏水的烧杯中充分溶解就可配得该浓度的硫酸溶液 | |
| D. | 该浓度的硫酸具有酸的通性,但不具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
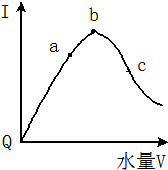 在室温下,冰醋酸加水稀释过程中,溶液导电能力I随加入水量(V表示体积)的变化曲线如图所示,请回答:
在室温下,冰醋酸加水稀释过程中,溶液导电能力I随加入水量(V表示体积)的变化曲线如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 侯氏制碱、肥皂的制取工艺过程中均应用了物质溶解度的差异 | |
| B. | 可用蘸浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| C. | 石油分馏、煤的气化、海水晒盐、碱去油污、花生中提取花生油等过程都是物理变化 | |
| D. | 利用钠的性质制造的高压钠灯,可发出射程远、透雾能力强的黄光 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/L | B. | 1.0mol/L | C. | 1.5mol/L | D. | 2.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y<Z<W | |
| B. | 单质的还原性:Y>Z | |
| C. | 气态氢化物的稳定性:X<W | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都可以与溴发生取代反应 | |
| B. | 都容易发生加成反应 | |
| C. | 乙烯易发生加成反应,苯不能发生加成反应 | |
| D. | 乙烯易被酸性高锰酸钾溶液氧化,而苯不能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com