
【题目】某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。
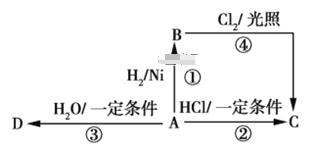
根据图回答下列问题。
(1) 写出A、B、C、D的结构简式:
A_______,B_______,
C_______,D_______。
(2)写出②、④两步反应的化学方程式,并注明反应类型:②_______________,反应类型_________;
④__________________________,反应类型______。
【答案】(1)CH2=CH2CH3CH3CH3CH2Cl CH3CH2OH
(2)CH2===CH2+HCl![]() CH3CH2Cl 加成反应;
CH3CH2Cl 加成反应;
CH3CH3+Cl2![]() CH3CH2Cl+HCl 取代反应
CH3CH2Cl+HCl 取代反应
【解析】
烃A的产量可以用来衡量一个国家的石油化工发展水平,还是一种植物生长调节剂,故A为CH2=CH2,CH2=CH2与氢气发生加成反应生成B,B为CH3CH3,乙烯与HCl发生加成反应生成C,C为CH3CH2Cl,乙烯与水发生加成反应生成D,D为CH3CH2OH,据此分析解答。
(1)由上述分析可知,A、B、C、D分别为CH2=CH2、CH3CH3、CH3CH2Cl、CH3CH2OH,故答案为:CH2═CH2;CH3CH3;CH3CH2Cl;CH3CH2OH;
(2)反应②为乙烯与HCl发生的加成反应,反应的化学方程式为CH2=CH2+HCl ![]() CH3CH2Cl;反应④为乙烷与氯气的取代反应,反应的化学方程式为CH3CH3+Cl2
CH3CH2Cl;反应④为乙烷与氯气的取代反应,反应的化学方程式为CH3CH3+Cl2 ![]() CH3CH2Cl+HCl,故答案为:CH2=CH2+HCl
CH3CH2Cl+HCl,故答案为:CH2=CH2+HCl ![]() CH3CH2Cl;加成反应;CH3CH3+Cl2
CH3CH2Cl;加成反应;CH3CH3+Cl2 ![]() CH3CH2Cl+HCl;取代反应。
CH3CH2Cl+HCl;取代反应。


科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的叙述正确的是
A. 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大
B. 常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-)
C. 在pH相同的盐酸和氯化铵溶液中水的电离程度相同
D. pH=11的NaOH溶液与pH=3醋酸溶液等体积混合,滴入石蕊溶液呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备,下列说法正确的是
SiO2 ![]() Si(粗)
Si(粗) 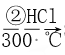 SiHCl3
SiHCl3 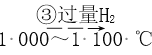 Si(纯)
Si(纯)
A. 步骤①的化学方程式为SiO2+C![]() Si+CO2↑
Si+CO2↑
B. 步骤①、②、③中每生成或反应1 mol Si,转移2 mol电子
C. 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D. SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏可提纯SiHCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。
(1)生成氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g)![]() H2(g)+CO(g) ΔH=+131.3 kJ·mol-1,ΔS=+133.7 J·mol-1·K-1,该反应在低温下________(“能”或“不能”)自发进行。
H2(g)+CO(g) ΔH=+131.3 kJ·mol-1,ΔS=+133.7 J·mol-1·K-1,该反应在低温下________(“能”或“不能”)自发进行。
(2)已知在400 ℃时,N2(g)+3H2(g)![]() 2NH3(g)的K=0.5。
2NH3(g)的K=0.5。
①在400 ℃时,2NH3(g)![]() N2(g)+3H2(g)的K′=________(填数值)。
N2(g)+3H2(g)的K′=________(填数值)。
②400 ℃时,在0.5 L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2 mol、1 mol、2 mol,则此时反应v正(N2)________(填“>”“<”“=”或“不能确定”)v逆(N2)。
③若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡________(填“向左”“向右”或“不”)移动;使用催化剂________(填“增大”“减小”或“不改变”)反应的ΔH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个装有CH4和Cl2 混合气体的集气瓶,用玻璃片盖好瓶口后,分别作如下处理,各有怎样的现象发生?
(1)①置于黑暗中: _____________________;
②将点燃的镁条靠近集气瓶外壁: ________________________;
③放在有光线的房子里: __________________________________。
(2)CH4和Cl2发生的一系列反应都是___________(填反应类型)反应,请写出CH4和Cl2反应生成一氯甲烷的化学方程式: ________________________________。
(3)若要使0.5 mol CH4完全和Cl2发生取代反应,并生成相同物质的量的四种取代产物,则生成HCl的物质的量为_________。
A.2.5mol B.2mol C.1.25mol D.0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,配制一组c(H2A)+ c(HA-)+ c(A2-)=0.100 mol·L-1的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法正确的是

A. H2A在水中的电离方程式为:H2A=HA-+ H+,HA-![]() H++A2-
H++A2-
B. c(Na+)=0.100 mol·L-1的溶液中,c(H+)+c(H2A)=c(OH-)+ c(A2-)
C. pH=4的溶液中,c(HA-)>c(H2A)+ c(A2-)
D. pH=7的溶液中,c(Na+)=2c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池反应为:Pb + PbO2 + 2H2SO4![]() 2PbSO4 + 2H2O 。下列说法中正确的是
2PbSO4 + 2H2O 。下列说法中正确的是
A. PbO2得电子,被氧化
B. 铅蓄电池工作过程中每通过2mol电子,负极质量减少207g
C. 电流是由PbO2经外电路流向Pb
D. 电池放电时,溶液酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。
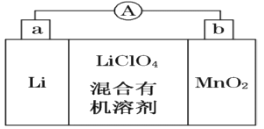
回答下列问题:
(1)外电路的电流方向是由______极流向______极。(填字母)
(2)电池正极反应式为 _____________________。
(3)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为 _________________。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为__________。
(4)电解Na2CO3溶液,原理如图所示。
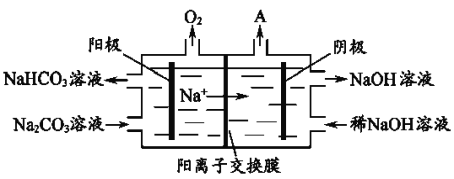
阳极的电极反应式为__________________,阴极产生的物质A的化学式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com