
【题目】物质燃烧的条件是
A.与大量空气接触B.与空气接触
C.与空气的接触面要大D.温度要达到可燃物的着火点
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】根据以上数据,磷原子的半径可能是
原子 | N | S | O | Si |
半径/nm | 0.075 | 0.102 | 0.074 | 0.117 |
A.0.080 nmB.0.110 nmC.0.120 nmD.0.070 nm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】其他条件不变时,能使反应速率加快的是 ( )
A. 对于反应Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,增大体系的压强
B. 对于反应N2(g)+3H2(g)![]() 2NH3(g),容器体积固定不变时,充入N2
2NH3(g),容器体积固定不变时,充入N2
C. 对于反应N2(g)+3H2(g)![]() 2NH3(g),容器体积固定不变时,充入Ar
2NH3(g),容器体积固定不变时,充入Ar
D. 对于反应N2(g)+3H2(g)![]() 2NH3(g),容器气体压强不变时,充入Ar
2NH3(g),容器气体压强不变时,充入Ar
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】齐墩果酸临床用于治疗传染性急性黄疸型肝炎,其结构简式如图所示,下列说法不正确的是

A. 齐墩果酸能使酸性KMnO4溶液褪色 B. 齐墩果酸能和NaHCO3溶液反应产生气体
C. 齐墩果酸分子间能形成酯 D. 齐墩果酸能发生加成反应、取代反应、水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3mol·L-1,则该溶液中该溶质的pC=-lg(1×10-3) = 3。下图为25℃时H2CO3溶液的pC-pH图(若离子浓度小于10-5 mol·L-1,可认为该离子不存在)。下列说法错误的是

A. 向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-)+c(Cl-)
B. 25℃时,H2CO3的一级电离平衡常数Ka1= 10-6
C. 25℃时,CO2饱和溶液的浓度是0.05 mol·L-1,其中1/5的CO2转变为H2CO3,若此时溶液的pH 约为5,据此可得该温度下CO2饱和溶液中H2CO3的电离度约为1%
D. 25℃时,0.1 mol·L-1,的Na2CO3和0.1 mol·L-1的NaHCO3混合溶液中离子浓度的大小为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前钴酸锂(LiCoO2)锂离子电池应用十分广泛,从废旧钴酸锂理离子电池中回收铝、铁、钴、锂等元素成了重要的研究课题,某小组模拟工业流程从废旧电池中对上述元素进行提取。
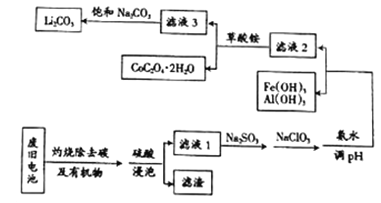
已知:①滤液1中阳离子有H+、CO3+、Fe3+、Al3+、Li+等;
②几种物质不同温度下的溶解度如下表所示:
T/℃ | 20 | 40 | 60 | 80 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)钴酸锂(LiCoO2)中钴元素的化合价是_______________。
(2)上述流程中将CoO2-转化为Co3+的离子方程式为_________________。
(3)滤液1中加入Na2SO3的主要目的是_____________________;加入NaClO3的主要目的是____________。
(4)为了使Fe3+、Al3+沉淀完全(通常认为金属离子浓度小于或等于10-5mol·L-1时表示已沉淀完全)加入氨水调节pH的最小值是____________(保留一位小数)。{已知:Ksp[Fe(OH)3]=1.0×10-39,Ksp[Al(OH)3]=2.7×10-34,lg3=0.52}
(5)滤液3中加入饱和Na2CO3溶液,过滤后,需要用“热水洗涤”的原因是_________。
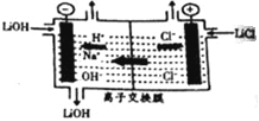
(6)为得到高纯度的Li2CO3,需将粗产品Li2CO3与盐酸反应制得的LiCl进行电解。其原理如图所示:
①电解时阳极的电解反应式为_____________________。
②电解后向产品LiOH溶液中加入过滤NH4HCO3溶液生成Li2CO3,反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容积的容器中进行反应:2SO2(g)+O2(g) ![]() 2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 molL-1、0.1 molL-1、0.2 molL-1。当反应达平衡时,可能存在的数据是
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 molL-1、0.1 molL-1、0.2 molL-1。当反应达平衡时,可能存在的数据是
A. SO2为0.4 molL-1,O2为0.2 molL-1 B. SO2为0.25 molL-1
C. SO2、SO3均为0.15 molL-1 D. SO3为0.4 molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是( )
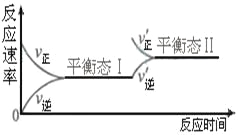
A. 反应达平衡时,正反应速率和逆反应速率相等
B. 该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态Ⅱ
C. 该反应达到平衡态后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ
D. 同一种反应物在平衡态Ⅰ和平衡Ⅱ时浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳热还原制备氮化铝的总反应化学方程式为:Al2O3(s)+3C(s)+N2(g)![]() 2AlN(s)+3CO(g)。在温度、容积恒定的反应体系中,CO浓度随时间的变化关系如图曲线甲所示。下列说法不正确的是
2AlN(s)+3CO(g)。在温度、容积恒定的反应体系中,CO浓度随时间的变化关系如图曲线甲所示。下列说法不正确的是

A. 在不同时刻都存在关系:v(N2)=3v(CO)
B. c点切线的斜率表示该化学反应在t时刻的瞬时速率
C. 从a、b两点坐标可求得从a到b时间间隔内该化学反应的平均速率
D. 维持温度、容积不变,若减少N2的物质的量进行反应,曲线甲将转变为曲线乙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com