
| A、(NH4)2Fe(SO4)2溶液中:Ba2+、K+、OH-、Br- | ||||
B、c(I-)=0.1 mol?L-1的溶液中:Na+、Fe3+、ClO-、S
| ||||
C、c(OH-)/c(H+)=10-12的溶液中:N
| ||||
D、新制饱和氯水中:Na+、Al3+、S
|


科目:高中化学 来源: 题型:
| A、和酸反应放出等量的CO2所消耗的酸比Na2CO3少 |
| B、相同温度下溶解度比Na2CO3要大 |
| C、热稳定性比Na2CO3强 |
| D、NaHCO3只能和酸作用不能和碱作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向试管中加入相同体积浓度为0.005 mol?L-1的FeCl3溶液和0.01 mol?L-1的KSCN溶液,再加入几滴饱和FeCl3溶液; 证明增大反应物浓度,平衡向正反应方向移动. |
| B、将Cl2通入0.1 mol?L-1KBr溶液中,再加入少量CCl4,振荡; 证明氯、溴的非金属性强弱. |
| C、用饱和Na2CO3溶液可将BaSO4转化为BaCO3; 证明Ksp(BaCO3)>Ksp(BaSO4). |
| D、用pH计测定0.1 mol?L-1醋酸溶液的Ph; 证明醋酸在水溶液中部分电离. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O |
| B、向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O |
| C、向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤,目的是除去MgCl2溶液中少量的FeCl3 |
| D、用FeCl3溶液腐蚀铜线路板:Cu+Fe3+═Cu2++Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
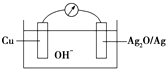 普通水泥在固化过程中自由水分子减少并产生Ca(OH)2,溶液呈碱性.根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间. 此方法的原理如图所示,反应的总方程式为:2Cu+Ag2O═Cu2O+2Ag,下列有关说法正确的是( )
普通水泥在固化过程中自由水分子减少并产生Ca(OH)2,溶液呈碱性.根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间. 此方法的原理如图所示,反应的总方程式为:2Cu+Ag2O═Cu2O+2Ag,下列有关说法正确的是( )| A、普通水泥的主要成分是2CaO?SiO2,3CaO?SiO2和3CaO?Al2O3 |
| B、测量原理示意图中,Ag2O为负极 |
| C、正极的电极反应为:2Cu+2OH--2e-═Cu2O+H2O |
| D、电池工作时,OH-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
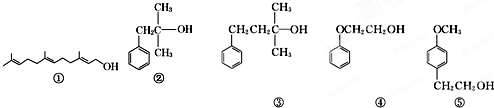
| A、可用酸性KMnO4溶液检验①中是否含有碳碳双键 |
| B、②和③互为同系物,均能催化氧化生成醛 |
| C、④和⑤互为同系物,可用核磁共振氢谱检验 |
| D、等物质的量的上述5种有机物与足量的金属钠反应,消耗钠的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 反应N2(g)+3H2(g)?2NH3(g);△H<0在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示.下列说法不正确的是( )
反应N2(g)+3H2(g)?2NH3(g);△H<0在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示.下列说法不正确的是( )| A、第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3):T2<T3 |
| B、Ⅰ、Ⅱ、Ⅲ三个阶段H2的转化率:αⅠ(H2)>αⅡ(H2)>αⅢ(H2) |
| C、Ⅰ、Ⅱ、Ⅲ三个阶段平均反应速率:vⅠ(N2)>vⅡ(N2)>vⅢ(N2) |
| D、第Ⅱ阶段采取的措施是将NH3从第Ⅰ阶段平衡混合物中分离出去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com