
短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如表:
(1)D原子结构示意图为 _______ ,A在周期表中的位置为 。
(2)B和C形成的化合物的电子式为 。
(3)B和D简单离子的半径大小为 。
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是 (填序号)。
a.比较两种单质的颜色
b.比较两种单质与H2化合的难易程度
c.依据两元素在周期表中的位置
d.比较对应阴离子的还原性
e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1∶3,相对分子质量为120.5,则该物质的化学式为 。
 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:填空题
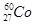 的衰变方程式为
的衰变方程式为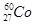 =
=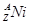 +
+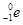 +Ve,其中Ve是反中微子,它的电荷为零,静止质量可以为零。
+Ve,其中Ve是反中微子,它的电荷为零,静止质量可以为零。
(1)下列关于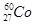 的叙述中,错误的是________(填序号)。
的叙述中,错误的是________(填序号)。
A.质子数是27 B.电子数是27
C.质量数是27 D.中子数是60
(2)在上述衰变方程中,衰变产物Ni的质量数A为______,核电荷数Z为________。
(3)元素的化学性质主要取决于________(填序号)。
A.最外层电子数 B.核内中子数
C.核内质子数 D.质量数不同
(4)不同种元素的本质区别是________(填序号)。
A.质子数不同 B.中子数不同
C.电子数不同 D.质量数不同
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F元素是原子序数依次增大的6种短周期元素。已知A是短周期元素中原子半径最小的元素,A和B形成的18电子的化合物X常用作火箭的燃料,C原子最外层电子数与核外电子总数之比为3∶4,E与C同主族,D和C可以形成原子个数比为1∶1和2∶1的两种离子化合物。
据此回答下列问题:
(1)D和C形成1∶1的化合物中阴阳离个数比为____________。
(2)化合物X的结构式为____________。1 mol气态X在适量C2中燃烧,生成B2和气态A2C, 放出534 kJ的热量,1 mol液态A2C完全汽化需吸收44 kJ热量。请写出气态X在C2中燃烧生成B2和液态A2C时的热化学方程式_____________________________________
(3)某化合物由上述6种元素中的3种元素组成,为常见家用消毒剂的主要成分,其中化学键类型为__________________;该化合物水溶液不呈中性的原因是(用离子方程式表示)__________________________________,该化合物可以通过电解D和F形成化合物的水溶液获得,电解时反应的化学方程式为_________________________________
(4)写出一个可以证明C的非金属性大于E的化学反应方程式:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
W、X、Y、Z是元素周期表中原子前四周期的四种元素,有关它们的信息如下表所示。
| 元素 | 相关信息 |
| W | W的基态原子L层电子数是K层电子数的3倍 |
| X | X与氢元素形成的一种化合物可以使湿润的红色石蕊试纸变蓝 |
| Y | 单质为黄绿色气体,最高价氧化物对应的水化物化学式为HYO4 |
| Z | Z的基态原子外围电子排布式为(n-1)d10ns1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表列出了A~R十种元素在周期表中的位置:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | | | | E | R | F | |
| 3 | A | C | D | H | | I | G |
| 4 | B | | | | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A_和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。回答下列问题:
(1)D2+的价层电子排布图为_______________。
(2)四种元素中第一电离最小的是_________________,电负性最大的是________________。(填元素符号)
(3)A、B和D三种元素组成的一个化合物的晶胞如图所示。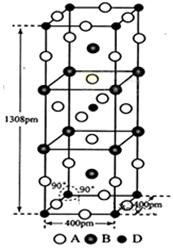
①该化合物的化学式为_____________;D的配位数为_______;
②列式计算该晶体的密度为___________g·cm-3。(列式并计算)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E为元素周期表中短周期元素形成的五种离子,A、B、C、D四种离子的电子数均比E的电子数少8。
(1)A与B结合成的化合物甲中既有离子键又有共价键,A与C结合成的化合物乙难溶于水,乙溶于甲的水溶液得无色透明溶液,C元素在周期表中的位置为 _ ,乙与甲的水溶液反应的离子方程式为__________________________________.
(2)B与E结合成化合物丙,其中离子数之比为2∶1,A与D结合成化合物丁,丁与丙反应产生无色无味的气体,则丙的电子式为: _ ,1molD的粒子中有 _ mol质子
(3)有一种液态氮氢化合物戊,戊分子与E的电子数相同,是“神舟七号”飞船发射时使用的高能燃料之一,结构分析发现该分子结构中只有单键,与氨相似,则戊的结构式为 ___。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、 F是周期表中短周期的六种元素,有关性质或结构信息如下表:
| 元素 | 有关性质或结构信息 |
| A | 雷雨天大气中会有A的一种单质生成 |
| B | B离子与A离子电子数相同,且是所在周期中单核离子半径最小的 |
| C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
| D | D是制造黑火药的一种成分,也可用于杀菌消毒 |
| E | E与D同周期,且在该周期中原子半径最小Ks5u |
| F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为 ,XW的电子式为 ;
(2)Z元素在周期表中的位置是 。
(3)元素U、V、W形成的10电子氢化物中,沸点较低的是 (写化学式);结合H+能力较强的是 (写化学式);用一个离子方程式加以说明 。
(4)YW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为 ,由此可知VW和YW2还原性较强的是 (写化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com