

| ||
| 0.144g |
| 0.16g |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
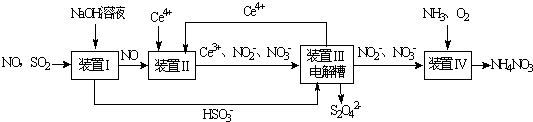
科目:高中化学 来源: 题型:
A、 如图装置用来电解饱和食盐水,C电极产生的气体能使湿润的淀粉KI试纸变蓝 |
B、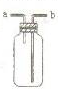 如图装置可用于收集H2、NH3、Cl2、HCl、NO2 |
C、 如图装置中X为苯,可用于吸收氮气或氯气 |
D、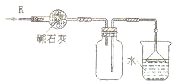 如图装置可用于干燥、收集氨气、并吸收多余的氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、宁波从2012年3月25日起公布了空气中的PM2.5,PM2.5是指空气中细颗粒物直径≤2.5pm的颗粒物 |
| B、“可燃冰”的燃烧、从海水中提取镁、铜的电解精炼、石油分馏全都是化学变化的过程 |
| C、蛋白质的二级结构主要依靠肽链中-NH-上的氢原子与羰基上的氧原子形成氢键而实现的 |
D、原子结构模型的演变历史可表示为: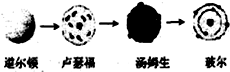 PM2.5是指空气中细颗粒物直径≤2.5 p m的颗粒物 PM2.5是指空气中细颗粒物直径≤2.5 p m的颗粒物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、做化学实验时产生的废液应倒入废液缸里 |
| B、熄灭酒精灯时,用嘴吹灭 |
| C、炒菜时油锅着火,立即盖上锅盖 |
| D、误食重金属盐,应喝豆浆、牛奶或鸡蛋清等解毒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com