
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,工作原理如图所示.下列说法错误的是

A.电池放电时Na+从a极区移向b极区
B.电极b采用MnO2,MnO2既作电极材料又有催化作用
C.每消耗3molH2O2,转移的电子为3mol
D.该电池的a极反应为:BH4-+8OH--8e-═BO2-+6H2O
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源:2017届湖北省高三上第四次质检化学试卷(解析版) 题型:选择题
其他条件不变,升高温度下列数据不一定增大的是( )
A.可逆反应的化学平衡常数K B.0.1 mol/L CH3COONa溶液的pH
C.水的离子积常数KW D.弱电解质的电离程度
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上10月月考化学试卷(解析版) 题型:选择题
在传统的硝化法制硫酸 中,其关键反应为NO2 + SO2 = NO + SO3,2NO + O2 = 2NO2 ,SO3 + H2O = H2SO4。据此,对有关物质氧化性的相对强弱顺序判断正确的是( )
中,其关键反应为NO2 + SO2 = NO + SO3,2NO + O2 = 2NO2 ,SO3 + H2O = H2SO4。据此,对有关物质氧化性的相对强弱顺序判断正确的是( )
A.H2SO4>NO2>O2 B.O2>SO3>H2SO4
C.NO2>O2>SO3 D.O2>NO2>SO3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:实验题
某实验小组用0.50mol/LNaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50mol/LNaOH溶液
若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体___________g
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。
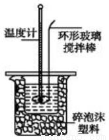
取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
(1)写出该反应的热化学方程式为___________(中和热为57.3kJ/mol);
(2)①请填写下表中的空白:
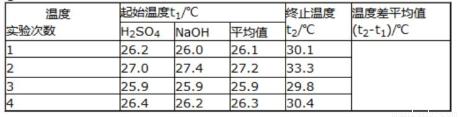
②近似认为0.50mol/LNaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃)。则中和热△H=___________(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是___________(填字母)
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
下列各装置中都盛有0.1mol/L的NaCl溶液,放置一定时间后,装置中的四块相同的锌片,腐蚀速率由快到慢的正确顺序是
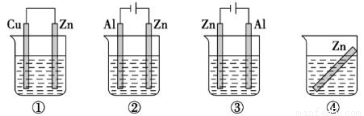
A.③①④②
B.①②④③
C.①②③④
D.②①④③
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:填空题
室温下将a mL三种一元酸分别和NaOH溶液等体积混合,实验数据如下:
组别 | c(一元酸) | c(NaOH) / mol·L-1 | 混合溶液的pH |
甲 | c(HX)=0.1 mol·L-1 | 0.1 | pH = 10 |
乙 | c(HY)=0.1 mol·L-1 | 0.1 | pH = 7 |
丙 | c(HZ)=0.1 mol·L-1 | 0.1 | pH = 9 |
(1)根据表中数据比较HX、HY、HZ三种酸的酸性由强到弱的顺序为_________,丙组实验发生反应的离子方程式为 ,所得溶液中由水电离出的c(OH-)= mol·L-1。
(2)部分实验反应过程中的pH变化曲线如下图:
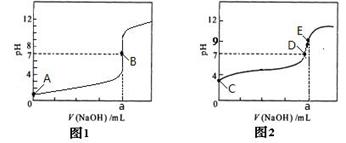
①表示乙组实验的pH变化曲线是________________(填“图1”或“图2”)
②以上两图中表示溶液恰好完全反应的点是________________。
(3)常温下,将pH=3的盐酸aL分别与下列三种溶液混合,所得溶液均呈中性。
①浓度为1.0×10-3 mol·L-1的氨水b L
②c(OH-)=1.0×10-3 mol·L-1的氨水c L
③c(OH-)=1.0×10-3 mol·L-1的氢氧化钡溶液d L。则a、b、c、d的大小关系是_________________。
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是__________(填“A”或“B”);设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1__________m2(填“<”、“=”、“>”)
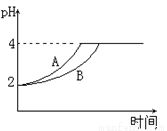
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
某密闭容器中发生反应:X(g)+3Y(g) 2Z(g) △H<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g) △H<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
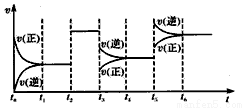
A.t2时加入了催化剂 B.T3时平衡的移动可使化学平衡常数减小
C.t5时增大了压强 D.T6时达到平衡后反应物的转化率最大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:填空题
Ⅰ.工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g) CH3OCH3(g)+3H2O(g) △H<0
CH3OCH3(g)+3H2O(g) △H<0
温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产率将_________(填“变大”、“变小”或“不变”,下同),混合气体的平均相对分子质量将_______________。
Ⅱ.某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应4NO2(g)+O2(g)?2N2O5(g) △H<0的影响.
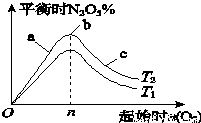
(1)图象中T1和T2的关系是T1_________T2(填“>”、“<”或“=”);
(2)比较a、b、c三点所处的平衡状态中,反应物NO2的转化率最大的是_________(填字母);
(3)若容器体积为1L,n=1mol,NO2的转化率为50%,则此条件下(T2),反应的平衡常数K=_________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com