
| Wg×22.4L |
| 46g |
| W×22.4 |
| 46 |
| W×22.4 |
| 24 |
| W×67.2 |
| 54 |
| W×22.4 |
| 46 |
| W×22.4 |
| 24 |
| W×67.2 |
| 54 |
| 1 |
| 23 |
| 1 |
| 12 |
| 1 |
| 9 |
| 1 |
| 23 |
| 1 |
| 12 |
| 1 |
| 9 |
| 1 |
| 2 |
| 3 |
| 2 |
| 2 |
| 3 |


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
| A、NH3中存在极性共价键 |
| B、稀有气体形成的单质没有化学键 |
| C、氯化钠中各离子均达到8电子稳定结构 |
| D、形成离子键的阴、阳离子间的作用力只存在静电吸引 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上以CO和H2为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上以CO和H2为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X有三种同位素 |
| B、其中一种同位素的原子质量数为81 |
| C、质量数为79的同位素,其原子质量分数为50% |
| D、X2的平均相对分子质量为159 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4种 | B、5种 | C、6种 | D、7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
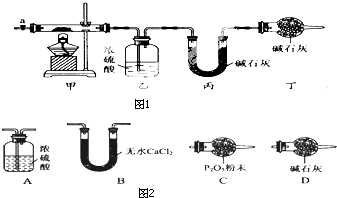 碱式碳酸钴[Cox(OH)y(C03)z]常用作电子材料、磁性材料的添加剂,受热时可分解生喊三种氧化物.为了确定其组成,某化学兴趣小组同学设计了如图1所示的装置进行实验.
碱式碳酸钴[Cox(OH)y(C03)z]常用作电子材料、磁性材料的添加剂,受热时可分解生喊三种氧化物.为了确定其组成,某化学兴趣小组同学设计了如图1所示的装置进行实验.| 乙装置的质量/g | 丙装置的质量/g | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com