
【题目】CO2是重要的化工原料,也是应用广发的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。
完成下列计算:
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00 mol NH4HCO3完全分解,分解产物经干燥后的体积为_________L(标准状况)。
(2)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______。
(3)CO2和KO2有下列反应:4KO2+2CO2→2K2CO3+3O2,4KO2+4CO2+2H2O→4KHCO3+3O2,若9 mol CO2在密封舱内和KO2反应后生成9 mol O2,则反应前密封舱内H2O的量应该是多少_______?列式计算。
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O![]() CO+3H2,已知:CO+2H2
CO+3H2,已知:CO+2H2![]() CH3OH,CO2+3H2
CH3OH,CO2+3H2![]() CH3OH+H2O。300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率_______。
CH3OH+H2O。300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率_______。
【答案】89.62.4 mol/L≥c≥1.2mol/L8KO2+6CO2+2H2O=2K2CO3+4KHCO3+6O2
n(CO2)∶n(O2)=6∶2
n(H2O)=(9/6)×2=3(mol)300 mol CH4完全反应产生H2 900mol
设CO2转化率为α,CO转化率为β
300β+100α=350 600β+300α=900-120
α=80%
或设CO2转化率为α
900350×2100α=120
α=80/100=80%
【解析】
试题
(1)碳酸氢铵分解的化学方程式为:NH4HCO3![]() H2O+NH3↑+CO2↑,从方程式可以看出,分解产物经干燥后,所得气体为NH3和CO2,且n(NH3)+ n(CO2)=2n(NH4HCO3)=2×2.00mol=4.00mol,则V(混合气体)=4.00mol×22.4L/mol=89.6L,即分解产物经干燥后的体积为89.6L。
H2O+NH3↑+CO2↑,从方程式可以看出,分解产物经干燥后,所得气体为NH3和CO2,且n(NH3)+ n(CO2)=2n(NH4HCO3)=2×2.00mol=4.00mol,则V(混合气体)=4.00mol×22.4L/mol=89.6L,即分解产物经干燥后的体积为89.6L。
(2)根据题意要求,2.40 molCO2被完全吸收,NaOH也完全反应,则反应的产物可能是Na2CO3(此时NaOH的浓度最大)或NaHCO3(此时NaOH的浓度最小)或Na2CO3和NaHCO3的混合物。用极值思想分析两个特殊情况:
①CO2+NaOH=NaHCO3,n(NaOH)= n(CO2)=2.40mol,则c(NaOH)=![]() =1.20mol/L;
=1.20mol/L;
②CO2+2NaOH=Na2CO3+H2O,n(NaOH)=2n(CO2)=4.80mol,则c(NaOH)=![]() =2.40mol/L;
=2.40mol/L;
综合(1)、(2)可知,NaOH溶液的浓度应该为1.20mol/L≤c(NaOH)≤2.40mol/L。
(3)法一:
依题意,9 mol CO2在密封舱内和KO2反应后生成9 mol O2,即n(CO2)∶n(O2)=1∶1,通过观察题给两个方程式可知,当把两个方程式相加时正好符合题目要求:
8KO2+6CO2+2H2O→2K2CO3+4KHCO3+6O2
所以有n(H2O)=![]() n(CO2)=
n(CO2)=![]() ×9mol=3mol,即反应前密封舱内H2O的物质的量为3mol。
×9mol=3mol,即反应前密封舱内H2O的物质的量为3mol。
法二:
设反应前密封舱内H2O的物质的量为n
4KO2+ 4CO2+ 2H2O → 4KHCO3+ 3O2
2nn 1.5n
4KO2+ 2CO2→ 2K2CO3+ 3O2
9-2n 1.5(9-2n)
根据题意生成氧气9mol,所以有1.5n+ 1.5(9-2n)=9mol,解得n=3mol,即反应前密封舱内
H2O的物质的量为3mol。
(4)法一:
CH4+ H2O![]() CO + 3H2
CO + 3H2
300mol 300mol 900mol
设CO2的转化率为α,CO的转化率为β
CO + 2H2![]() CH3OH CO2+ 3H2
CH3OH CO2+ 3H2![]() CH3OH + H2O
CH3OH + H2O
300βmol 600βmol 300βmol 100αmol 300αmol 100αmol
根据题意,共生成350mol甲醇,所以有300βmol+100αmol=350mol-------①式
根据题意,反应后残留氢气120mol,则实际参加反应的氢气为900mol-120 mol,所以有
600βmol+300αmol="900mol-120" mol--------②式
由①②式可得α=0.8,即CO2的转化率为80%。
法二:
在合成甲醇的反应中,氢元素在生成物中有两种存在形式,一是存在于甲醇中,二是存在于水中,设CO2的转化率为α
CH4+ H2O![]() CO + 3H2
CO + 3H2
300mol 900mol
CO2+ 3H2![]() CH3OH + H2O
CH3OH + H2O
100αmol 100αmol
根据题意,反应后残留氢气120mol,则实际参加反应的氢气为900mol-120 mol,根据反应中氢元素的守恒可有:900mol-120mol=350mol×2+100αmol,解得α=0.8,即CO2的转化率为80%。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_________。
(2)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。

①用离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性增大,CrO42的平衡转化率__________(填“增大“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH_________(填“大于”“小于”或“等于”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中Cl恰好完全沉淀(浓度等于1.0×105mol·L1)时,溶液中c(Ag+)为_______ mol·L1,此时溶液中c(CrO42)等于__________ mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72还原成Cr3+,反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用还原法可以将硝酸厂烟气中的大量氮氧化物(NOx),转化为无害物质。常温下,将NO与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中,其转化过程如下图所示。下列说法不正确的是
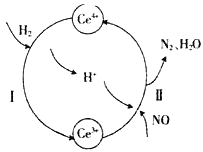
A. 反应I的离子反应方程式为2Ce4++H2=2Ce3++2H+
B. 反应II中氧化剂与还原剂的物质的量之比为1:2
C. 反应前溶液中c(Ce4+)一定等于反应后溶液中的c(Ce4+)
D. 反应过程中混合溶液内Ce3+和Ce4+离子的总数一定保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,下列有关该有机物的说法不正确的是

①分子式为C10H18O3
②易溶于水
③分子中含有两种官能团
④可使溴水和酸性高锰酸钾溶液褪色,且褪色原理相同
⑤能发生加成、取代、酯化、消去、催化氧化等反应
⑥所有的原子可能共平面
A. ①②③④⑤ B. ①②⑤⑥ C. ①②④⑤⑥ D. 全部不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数的值用NA表示,气体摩尔体积用Vm表示则:
(1)该气体的物质的量为________。
(2)该气体所含分子数为________。
(3)该气体所含原子总数为________。
(4)该气体在标准状况下的体积为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下①6.72 L CH4②3.01×1023个HCl分子 ③13.6 g H2S④0.2 mol NH3,下列对这四种气体的关系从大到小表达正确的是( )
a.体积②>③>①>④
b.密度②>③>④>①
c.质量②>③>①>④
d.氢原子个数①>③>④>②
A. abcB. bcdC. acdD. abcd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是

A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D. a和b用导线连接时,铁片作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年是太原市创建第六届全国文明城市的攻坚之年,目标是努力打造宜居、宜业、宜乐、宜游的良好环境,持续提升城市文明程度和市民文明素质。下列做法不符合这一目标的是( )
A.使用可降解快餐盒
B.种植绿色无公害蔬菜
C.随意丢弃使用过的医用口罩
D.将普通灯泡更换为LED节能灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g)![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2molSO2、1molO2 | 4molSO3 | 2molSO2、1molO2 |
平衡v正(SO2)/mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率a | a 1(SO2) | a 2(SO3) | a 3(SO2) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是
A. v1< v2,c2< 2c1 B. K1> K3,p2> 2p3
C. v1< v3,α1(SO2 ) < α3(SO2 ) D. c2> 2c3,α2(SO3 )+α3(SO2 )<1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com