
| A、m-n=b-a |
| B、元素原子序数a>b>c>d |
| C、元素非金属性:R>Z |
| D、最高价氧化物对应水化物的碱性X>Y |


科目:高中化学 来源: 题型:
| A、电子的运动与行星相似,围绕原子核在固定的轨道上高速旋转 |
| B、能量低的电子只能在s轨道上运动,能量高的电子总是在f轨道上运动 |
| C、能层序数越大,s原子轨道的半径越大 |
| D、某微粒的最外层电子排布为2s22p6,则该微粒为Ne |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag |
| B、铁和盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| C、硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| D、澄清石灰水与盐酸混合:Ca(OH)2+2H+=Ca2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸与锌反应放出的氢气多 |
| B、盐酸与锌反应放出的氢气多 |
| C、醋酸与锌反应的速率大 |
| D、盐酸和醋酸分别与锌反应速率一样大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
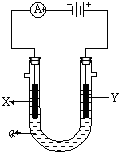 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、砷在通常状况下为固体 |
| B、砷的最高正化合价为+5 |
| C、砷的最高价氧化物的水化物砷酸(H3AsO4)的酸性比磷酸(H3PO4)强 |
| D、砷化氢(AsH3)比氨气(NH3)不稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、8.00 | B、7.92 |
| C、7.90 | D、7.86 |
查看答案和解析>>
科目:高中化学 来源: 题型:
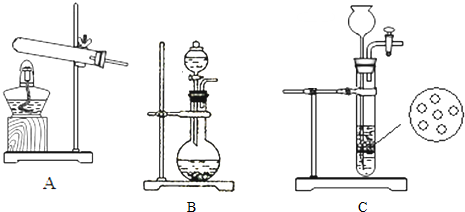
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 反应的化学方程式为 ① | |
| 乙小组 | 浓氨水、氢氧化钠固体 | 氢氧化钠的作用:氨水中存在平衡:NH4++OH-?NH3?H2O?NH3+H2O,NaOH固体溶于水,使溶液中c(OH-)增大,平衡向右移动,且NaOH固体溶于水时放热,溶液温度升高,平衡向右移动. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com