
| A、稳定性:H2S>HF |
| B、在卤化物中HF最稳定 |
| C、一个D2O分子所含的中子数为8 |
| D、HCl是离子化合物 |
科目:高中化学 来源: 题型:
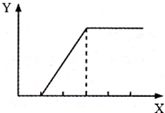 向含等物质的量两种溶质的甲溶液逐渐加入乙物质,生成不溶物的量(Y)与加入物的量(X) 之间的关系符合如图所示的是( )
向含等物质的量两种溶质的甲溶液逐渐加入乙物质,生成不溶物的量(Y)与加入物的量(X) 之间的关系符合如图所示的是( )| 甲溶液 | 乙物质 | |
| A | NaOH和Ca(OH)2 | CO2气体 |
| B | H2SO4和MgSO4 | NaOH溶液 |
| C | HCl和CaCl2 | Na2CO3溶液 |
| D | Fe2(SO4)3和CuSO4 | Fe粉 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、若电键K与N连接,铁为负极 |
| B、若电键K与N连接,正极反应式是O2+2H2+4e-═4OH- |
| C、若电键K与M连接,将石墨棒成铜棒,可实现铁棒上镀铜 |
| D、若电键K与M连接,当两极共产生28L(标准状况)气体是,生成了1molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镁的原子失电子能力比钠弱 |
| B、氟的氢化物很稳定 |
| C、硫的氢化物比氧的氢化物更不稳定 |
| D、氢氧化钠是弱碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、工业上可用电解法制备Mg:MgCl2
| ||||
| B、自然界中正常的雨水呈酸性:H2O+CO2?H2CO3?H++HCO3- | ||||
| C、用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)?CaCO3(s)+Na2SO4(aq) | ||||
| D、用FeSO4除去酸性废水中的Cr2O72-:Cr2O72-+Fe2++14H+═2Cr3++Fe3++7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.5g | B、3g |
| C、2g | D、4.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.| a | b | ||||||||||||||||
| c | d | ||||||||||||||||
| e | f | g | h | i | |||||||||||||
| j | |||||||||||||||||
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com