
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题:

(1)正四面体烷的分子式为________________,其二氯取代产物有_________种;
(2)关于乙烯基乙炔分子的说法错误的是:________。
a、能使酸性KMnO4溶液褪色
b、1摩尔乙烯基乙炔能与3摩尔Br2发生加成反应
c、生成乙烯基乙炔分子的反应属于取代反应
d、等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式:________________;
(4)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例): ________、________。
【答案】 C4H4 1种 d ![]()
![]()
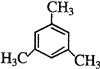
【解析】(1)正四面体烷中有4个碳原子,4个氢原子,正四面体烷的分子式为C4H4,正四面体烷中4个氢原子完全等效,所以其二氯代物只有1种;(2)a、因乙烯基乙炔为CH2=CH-C≡CH,乙烯基乙炔分子中含有一个碳碳双键、一个碳碳三键,而碳碳双键、碳碳三键都能使酸性KMnO4溶液褪色,故a正确;b.因1mol乙烯基乙炔分子中1mol碳碳双键、1mol碳碳三键,1mol碳碳双键能和1摩尔Br2发生加成反应,1mol碳碳三键能和2摩尔Br2发生加成反应,所以1摩尔乙烯基乙炔能与3摩尔Br2发生加成反应,故b正确;c.乙烯基乙炔分子中含有的官能团有:碳碳双键、碳碳三键,生成乙烯基乙炔分子的反应属于加故成c正确;d、因等质量的烃(CXHY)完全燃烧时耗氧量取决于x、y,乙烯基乙炔为CH2=CH-C≡CH最简式为CH,乙炔C2H2的最简式为CH,二者最简式相同,二者质量相同,消耗氧气相同,故d错误;故选d。(3)环辛四烯的分子式为C8H8,不饱和度为5,属于芳香烃的同分异构体,含有1个苯环,侧链不饱和度为1,故含有1个侧链为-CH=CH2,属于芳香烃的同分异构体的结构简式![]() ;(4)一氯代物只有两种,说明只有两种氢原子,故苯环上含有1种氢,侧链上也含有1种氢,且为苯的同系物,其结构简式可能为:
;(4)一氯代物只有两种,说明只有两种氢原子,故苯环上含有1种氢,侧链上也含有1种氢,且为苯的同系物,其结构简式可能为:![]() 、
、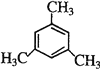 、
、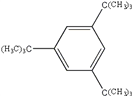 等。
等。


科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X、Y的核电荷数之比为3:4。W-的最外层为8电子结构。金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应。下列说法正确的是
A. 元素Y、Z的简单离子的电子层结构不同
B. 原子半径大小:r(X)<r(Y),r(Z)>r(W)
C. 化合物Z2Y和Z2XY3中都只存在离子键
D. 常温下,W的单质与Z的最高价氧化物水化物的溶液反应生成两种盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BPA的结构简式如右下图所示,常用来生产防碎塑料聚碳酸酯。

(1)该物质的分子式为___________,含氧官能团的名称是_________,属于____类。
(2)该物质最多_____个碳原子共面。
(3)充分燃烧0.1mol该有机物,消耗的O2在标准状况下的体积为_________。
(4)下列关于BPA的叙述中,不正确的是_______。
A.可以发生还原反应
B.遇FeCl3溶液紫色
C.1mol该有机物最多可与2molH2反应
D.可与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠大量用于染料和有机合成工业。用木屑制备亚硝酸钠的流程如下:

已知:①氧化过程中,控制反应液的温度在55~60℃,发生的主要反应为C6H12O6+12HNO3![]() 3H2C2O4+9NO2↑+3NO↑+9H2O;
3H2C2O4+9NO2↑+3NO↑+9H2O;
②NaNO2有氧化性,在酸性条件下能把I-氧化为I2;S2O32-能把I2还原为I-
③NaNO2也有还原性,能使酸性KMnO4溶液褪色
(1)酸溶过程中,发生的主要反应的化学方程式为______________。
(2)实验室模拟氧化和吸收过程的装置(加热和仪器固定裝置已略去)如下图所示

①实验装置图中仪器a的名称为______________。
②A装置须控制反应液的温度不高于60℃的原因是_____________。
③B装置用于制备亚硝酸钠,其中盛放的溶液是__________(填字母)。
a.NaCl溶液 b.Na2CO3溶液 c.NaNO3溶液
(3)工业上在吸收过程中需控制NO和NO2的物质的量比接近1:1。若n(NO):n(NO2)>l:1,则会导致________;若n(NO):n(NO2)<1:1,则会导致________。
(4)为测定产品NaNO2的纯度,请补充完整实验方案:准确称量适量的NaNO2样品放入锥形瓶中,加适量水溶解,________。(实验中可供选择的试剂:稀硫酸、淀粉溶液、酚酞试液、c1mol/LKI溶液、c2mol/LNa2S2O3溶液、c3mol/L酸性KMnO4溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生实验兴趣小组拟用图1装置气体排液法来完成“NaHCO3和NaCl混合物中NaHCO3含量的测定”的实验.
已知:Na2CO3+CO2+H2O=2NaHCO3 , CO2难溶于饱和NaHCO3溶液.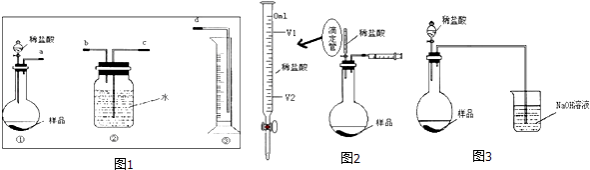
(1)各仪器接口连接顺序是(用接口字母填写).
(2)甲同学认为上述方法误差较大,提出如下改进措施,你认为可行的有 . (填序号)
A.在装置②中水面上滴加少量植物油
B.在装置①中稀盐酸换成稀硫酸,装置②中水换成饱和NaHCO3溶液
C.在装置②中水换成饱和Na2CO3溶液
D.滴加盐酸不宜过快
(3)乙同学认为在装置②③之间的导管内会积存水,使测定结果不准,从而改用图2装置.假定滴定管(用于准确测定滴加液体体积的仪器,其中0刻度在最上面,刻度从上到下依次增大)起始读数为V1mL,终了读数为V2mL,而注射器测定排出的气体为V3mL(标准状况下),混合物样品质量为m g,则原混合物中NaHCO3的质量分数的表达式为(用含V1、V2、V3、m的式子表示).
(4)丙同学改用图3装置,通过测定烧杯中NaOH溶液的增重来确定样品中NaHCO3的含量.你认为乙、丙两同学的方案中,谁的方案更合理 , 理由是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下有关物质的量浓度的叙述正确的是( )
A.等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液的物质的量浓度比为1:2:3
B.150 mL 1 mol?L﹣1的氯化钾溶液中的c(Cl﹣)与50 mL 1 mol?L﹣1的氯化铝溶液中的c(Cl﹣)相等
C.20℃时,饱和KCl溶液的密度为1.174 g?cm﹣3 , 物质的量浓度为4.0 mol?L﹣1 , 则此溶液中KCl的质量分数为 ![]() ×100%
×100%
D.20℃时,100 g水可溶解34.2 g KCl,此时KCl饱和溶液的质量分数为34.2%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的基础。下列关于各实验装置的叙述正确的是( )

A. 装置①常用于分离互不相溶的液体混合物
B. 装置②可用于吸收NH3或HCl气体,并防止倒吸
C. 装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
D. 装置③可用于收集H2、CO2、Cl2、NH3等气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com