
| A. | 化学反应不一定都有能量变化 | |
| B. | 增大反应物浓度,活化分子百分数增大,化学反应速率一定增大 | |
| C. | 升高温度,活化分子百分数增大,化学反应速率一定增大 | |
| D. | 一般使用催化剂可以降低反应的活化能,增大活化分子百分数,从而提高反应物的转化率 |
分析 化学反应一定伴随着能量变化,化学反应的热效应与反应的始态和终态有关,而与反应过程无关,压强、浓度只影响单位体积活化分子的数目,温度、催化剂影响活化分子的百分数,以此解答该题.
解答 解:A.化学反应的实质是旧键的断裂和新键的形成,旧键断裂吸收热量,形成新键放出热量,则化学反应一定伴有能量变化,故A正确;
B.浓度增大使得反应物分子中活化分子数目增大,但是活化分子百分数不变,故B错误;
C.升高温度活化分子数目增多,活化分子的百分数增多,故C正确;
D.催化剂同等程度改变正逆反应速率,平衡不移动,故D错误.
故选C.
点评 本题考查活化能及其对反应速率的影响,题目难度不大,注意温度、浓度、压强、催化剂等外界条件对化学反应速率的影响的根本原因是对活化分子的影响,但影响原因不同.


科目:高中化学 来源: 题型:选择题
| A. | 分子晶体中一定存在共价键和范德华力 | |
| B. | 由非金属元素组成的化合物一定是共价化合物 | |
| C. | 原子晶体和分子晶体一定均含有共价键,离子晶体也可能含有共价键 | |
| D. | 两个非金属元素原子间不可能形成离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的气化就是将煤在高温条件由固态转化为气态的物理变化过程 | |
| B. | 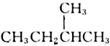 和 和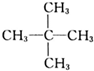 互为同分异构体 互为同分异构体 | |
| C. | 淀粉、蛋白质和油脂都是高聚物,在一定条件下都能水解 | |
| D. | 石油裂解可以得到更多的汽油,这种汽油是一种纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
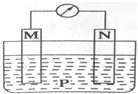 如图所示装置中,可观察到电流计指针偏转,M棒变粗,N棒变细.下表所列M、N、P物质中,可以组合成该装置的是( )
如图所示装置中,可观察到电流计指针偏转,M棒变粗,N棒变细.下表所列M、N、P物质中,可以组合成该装置的是( )| 选项号 | M | N | P |
| A | 铜 | 铁 | 稀盐酸 |
| B | 银 | 锌 | 硝酸银溶液 |
| C | 锌 | 铁 | 硝酸铁溶液 |
| D | 锌 | 铜 | 稀硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2mL Na2CO3溶液中滴加1mL 0.5mol•L-1 CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应:Ca2++CO32-═CaCO3↓ (离子方程式) |
| 操作2:向2mL NaHCO3溶液中滴加1mL 0.5mol•L-1CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | H2SO4 | C. | AgNO3 | D. | Na2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com