
【题目】(1)当SO2、SO3的分子个数之比为1∶1时,原子总数之比为________,质量之比为________。
(2)中和含0.2 mol HCl的稀盐酸,需NaOH的质量为________g。
(3)将5 mol·L-1的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO![]() 的物质的量浓度是______ mol·L-1。
的物质的量浓度是______ mol·L-1。
(4)用等体积的0.1 mol·L-1的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液中的SO![]() 都恰好完全沉淀,则三种硫酸盐的物质的量浓度之比为________。
都恰好完全沉淀,则三种硫酸盐的物质的量浓度之比为________。
【答案】3∶4 4∶58![]() 2∶6∶3
2∶6∶3
【解析】
(1)SO2为三原子分子,SO3为四原子分子,故当SO2、SO3的分子数相同时,原子总数之比为3∶4,质量之比等于它们的摩尔质量之比,即为64 g·mol-1∶80 g·mol-1=4∶5,故答案为: 3∶4、4∶5;(2)n(NaOH)=n(HCl)=0.2 mol,m(NaOH)=0.2 mol×40 g·mol-1=8 g,故答案为:8;(3)稀释前后NO![]() 的物质的量不变,即c(NO
的物质的量不变,即c(NO![]() )×b mL=2×5 mol·L-1×a mL,则稀释后c(NO
)×b mL=2×5 mol·L-1×a mL,则稀释后c(NO![]() )=
)=![]() mol·L-1;(4)由题意可知,三种溶液中的SO
mol·L-1;(4)由题意可知,三种溶液中的SO![]() 的物质的量相等,即3n[Fe2(SO4)3]=n(Na2SO4)=2n[KAl(SO4)2],则n[Fe2(SO4)3]∶n(Na2SO4)∶n[KAl(SO4)2]=
的物质的量相等,即3n[Fe2(SO4)3]=n(Na2SO4)=2n[KAl(SO4)2],则n[Fe2(SO4)3]∶n(Na2SO4)∶n[KAl(SO4)2]=![]() ∶1∶
∶1∶![]() =2∶6∶3;又因三种溶液体积相同,则三种硫酸盐的物质的量浓度之比等于其物质的量之比,故答案为:2∶6∶3。
=2∶6∶3;又因三种溶液体积相同,则三种硫酸盐的物质的量浓度之比等于其物质的量之比,故答案为:2∶6∶3。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】某学生社团根据老师的指导进行实验研究:一块下衬白纸的玻璃片上有a、b、c、d四个位置,分别滴加浓度为0.1 mol/L的四种溶液各1滴,每种彼此分开,形成一个个小液滴。在圆心e处放置2粒芝麻粒大小的KMnO4晶体,然后向KMnO4晶体滴加一滴浓盐酸,并将表面皿盖好。可观察到a、b、c、d、e五个位置均有明显反应。
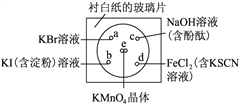
完成下列填空:
(1)e处立即发生反应,化学方程式如下,请配平,并标出电子转移方向和数目______。
![]() KMnO4+
KMnO4+![]() HCl(浓)→
HCl(浓)→![]() KCl+
KCl+![]() MnCl2+
MnCl2+![]() Cl2↑+
Cl2↑+![]() H2O
H2O
(2)在元素周期表中Cl、Br、I位于___________________ 族 ,它们最高价氧化物所对应水化物酸性最强的是__________________(填化学式)。
(3)b处实验现象为_____________________。d处反应的离子方程式为__________________,通过此实验________(填“能”或“不能”)比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱。若能,则其氧化性由强到弱的顺序是___________________________________。
(4)常温下,向饱和氯水中逐滴滴入0.1mol/L的氢氧化钠溶液,pH变化如下图所示,下列有关叙述正确的是__________。
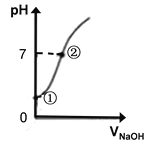
A.①处所示溶液中存在的电离平衡不止一个
B.由①到②的过程中,溶液由酸性逐渐变为碱性
C.由①到②的过程中,水的电离程度逐渐减弱
D.②处所示溶液中:c(Na+)=c(Cl-) + c(ClO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺流程如下:
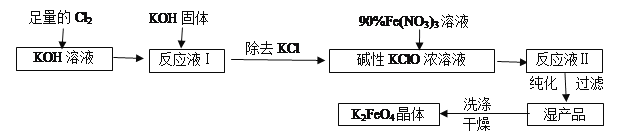
请回答下列问题:
(1)写出向KOH溶液中通入足量Cl2发生反应的离子方程式___________。
(2)在溶液Ⅰ中加入KOH固体的目的是________(填编号)。
A.为下一步反应提供碱性的环境
B.使KClO3转化为KClO
C.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO
D.KOH固体溶解时会放出较多的热量,有利于提高反应速率
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3,KCl,则反应③中发生的离子反应方程式为________。每制得59.4克K2FeO4,理论上消耗氧化剂的物质的量为________mol。
(4)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式: FeO42-+ H2O= Fe(OH)3(胶体)+ O2↑+ OH-。___________
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图所示。电解过程中阳极的电极反应式为_____________。
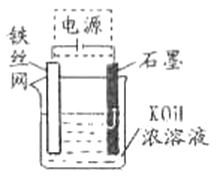
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
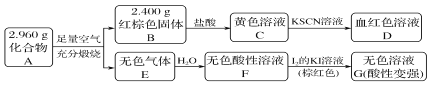
【题目】磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:
请回答:
(1)A的组成元素为________(用元素符号表示),化学式为_____________________。
(2)溶液C可溶解铜片,例举该反应的一个实际应用________。
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),该气体分子的电子式为________。写出该反应的离子方程式____________________。
写出F→G反应的化学方程式___________________________________。
设计实验方案探究溶液G中的主要微粒(不考虑H2O、H+、K+、I-) _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用0.lmol·L-1NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
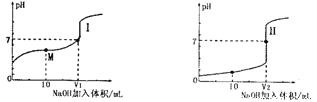
①滴定醋酸的曲线是__________(填“I”或“Ⅱ”)。
②V1和V2的关系:V1______V2(填“>”、“=”或“<”)
③M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_______________。
(2)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。资料:AgSCN是白色沉淀
操作步骤 | 现象 |
步骤1:向2mL0.005mol·L-1AgNO3溶液中 加入2mL0.005mol·L-1KSCN溶液,静置 | 出现白色沉淀 |
步骤2:取lmL上层清液于试管中,滴加1 滴2 mol·L-1Fe(NO3)3溶液 | 溶液变红色 |
步骤3:向步骤2的溶液中,继续加入5滴3mol·L-1 AgNO3溶液 | 出现白色沉淀,溶液红色变浅 |
步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液 | 出现黄色沉淀 |
①写出步骤2中溶液变红色的离子方程式______________________。
②用化学平衡原理解释步骤3的实验现象______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种优良的水处理剂。25℃,其水溶液中加酸或碱改变溶液的pH时,含铁粒子的物质的量分数δ(X)随pH的变化如图所示[已知δ(X)=  ]。下列说法正确的是
]。下列说法正确的是

A. K2FeO4、H2FeO4都属于强电解质
B. 25℃,H2FeO4+H+![]() H3FeO4+的平衡常数K>100
H3FeO4+的平衡常数K>100
C. 由B点数据可知,H2FeO4的第一步电离常数Ka1=4.15×10-4
D. A.C 两点对应溶液中水的电离程度: C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲将NaCl、CaCO3分离,可能会涉及如下操作步骤:
①溶解②过滤③蒸发结晶④洗涤⑤烘干⑥萃取,其中正确的是( )
A.①②③B.②③④⑤
C.①②③④⑤D.全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com