
| A. | 4 | B. | 6 | C. | 7 | D. | 8 |
分析 分子式为C4H10O的有机物,能与金属钠反应放出氢气,说明分子中含有-OH,该物质为丁醇,书写丁基-C4H9异构,丁基异构数目等于丁醇的异构体数目,可由醛还原而成的醇与羟基相连的碳上有2个氢原子.
解答 解:分子式为C4H10O的有机物,能与金属钠反应放出氢气,说明分子中含有-OH,该物质为丁醇,丁基-C4H9可能的结构有:-CH2CH2CH2CH3、-CH(CH3)CH2CH3、-CH2CH(CH3)2、-C(CH3)3,所以该有机物的可能结构有4种.
故选A.
点评 本题考查了同分异构体的书写等,难度中等,利用烃基异构判断,比书写丁醇的同分异构体简单容易,侧重于考查学生的分析能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属钠失火时立即用水灭火,然后用稀硫酸中和 | |
| B. | 为了防止挥发,氢氧化钠溶液保存在用磨砂玻璃塞的玻璃试剂瓶中 | |
| C. | 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 | |
| D. | 配置一定物质的量浓度溶液时,不慎将少量水加过刻度线,应重新配置 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
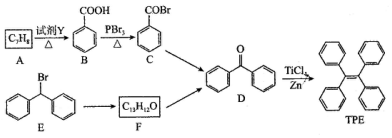
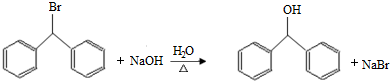 .
.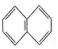 )的一元取代物;②存在羟甲基(-CH2OH).写出W所有可能的结构简式
)的一元取代物;②存在羟甲基(-CH2OH).写出W所有可能的结构简式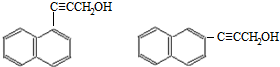 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与紫色石蕊溶液--先变红后褪色 | |
| B. | 过量的Cl2与KI淀粉溶液--变蓝 | |
| C. | SO2与紫色石蕊溶液--变红 | |
| D. | 硫化氢与湿润的醋酸铅试纸--变黑 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
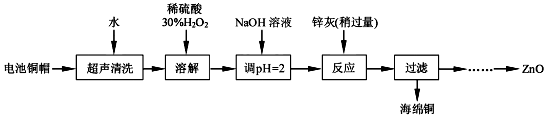
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 完全沉淀的pH | 3.2 | 8.8 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 编号 | 起始时各物质的物质的量/mol | 达到平衡时体系的变化 | 平衡时NH3的体积分数 | ||
| N2 | H2 | NH3 | |||
| ① | 1 | 3 | 0 | 放出热量:23.15 kJ | W1 |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q kJ | W2 |
| A. | W1>W2,Q<23.15 | B. | W1=W2,Q=23.15 | C. | W1<W2,Q>23.15 | D. | W1=W2,Q<23.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=4 | |
| B. | 平衡时气体压强是原来压强的1.1倍 | |
| C. | A的平衡浓度是1.4 mol•L-1 | |
| D. | B的转化率是40% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com