
【题目】龙葵醛( )是一种珍贵的香料,广泛应用于香料、医药、染料及农药等行业。以下是以苯为原料生成龙葵醛的一种合成路线(部分反应条件及副产物已略去):
)是一种珍贵的香料,广泛应用于香料、医药、染料及农药等行业。以下是以苯为原料生成龙葵醛的一种合成路线(部分反应条件及副产物已略去):

(1)龙葵醛的分子式为_______,其中官能团的名称是__________;
(2)A物质的核磁共振氢谱中有_______个吸收峰,B的结构简式可能为_______。
(3)反应③的反应类型为_______,反应⑤的反应条件为_______。
(4)反应⑥的化学方程式为___________。
(5)龙葵醛具有多种同分异构体,其中某些物质有下列特征:a.其水溶液遇FeCl3溶液呈紫色;b.能与Br2的CCl4发生加成反应。则符合上述条件的物质可能的结构有_______种。其中核磁共振氢谱为五组峰,峰面积比为1∶2∶2∶2∶3的结构简式为_______。
【答案】 C9H10O 醛基 5 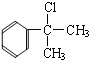 或
或![]() 消去 NaOH水溶液加热 2
消去 NaOH水溶液加热 2![]() +O2
+O2![]() 2
2![]() +2H2O 19
+2H2O 19 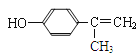
【解析】分析:根据题中各物质转化关系,比较苯和A的分子式以及其它各物质的分子式可知,反应①为加成反应,A在光照条件下发生侧链上取代生成B,B发生消去反应生成C,C与溴化氢发生加成反应生成D,D在碱性条件下加热,发生水解反应生成E,E发生氧化反应生成龙葵醛,根据龙葵醛的结构可反推得E为![]() ,D为
,D为![]() ,C为
,C为![]() ,B为
,B为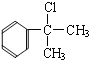 或
或![]() ,A为
,A为![]() ,据此解答。
,据此解答。
详解:(1)根据龙葵醛的结构简式可知分子式为C9H10O,其中含氧官能团的名称是醛基;
(2)A为![]() ,A分子中含有5种氢原子,则A物质的核磁共振氢谱中有5个吸收峰;根据以上分析可知B的结构简式可能为
,A分子中含有5种氢原子,则A物质的核磁共振氢谱中有5个吸收峰;根据以上分析可知B的结构简式可能为 或
或![]() ;
;
(3)根据以上分析可知反应③的反应类型为消去反应,反应⑤为D在碱性条件下加热,发生水解反应生成E,所以反应条件为NaOH的水溶液、加热;
(4)反应⑥是羟基的催化氧化,则反应的化学方程式为2![]() +O2
+O2![]() 2
2![]() +2H2O;
+2H2O;
(5)龙葵醛的同分异构体中a.其水溶液遇FeCl3溶液呈紫色,说明有酚羟基;b.能与Br2的CCl4发生加成反应,说明含有碳碳双键。根据苯环上含有2个取代基,应该是-OH与-CH=CHCH3或-OH与-CH2CH=CH2或-OH与-C(CH3)=CH2,均有邻间对三种;如果含有3个取代基,应该是-OH、-CH3、-CH=CH2,有10种,合计是19,其中核磁共振氢谱为五组峰,峰面积比为1∶2∶2∶2∶3的结构简式为 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGa g·mol-1和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生的主要反应为:![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g);在1000℃时,平衡常数为4.0;在1300℃时,平衡常数为3.5。下列说法中,正确的是( )
Fe(s)+CO2(g);在1000℃时,平衡常数为4.0;在1300℃时,平衡常数为3.5。下列说法中,正确的是( )
A. 平衡常数的表达式为:K=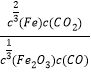
B. 在1000℃时,10L的密闭容器中,加入Fe、Fe2O3、CO、CO2各1mol,10min达到平衡,υ(CO2)=0.006mol/(L·min)
C. 一段时间以后,铁的量不再变化,不能说明该反应达到平衡
D. 下图表示不同温度下,CO的转化率与时间关系图像
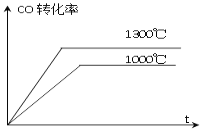
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在人类生活、生产中发挥着重要的作用。
(1)下列物质中不属于合金的是_______。
A.钢 B.青铜 C.黄铜 D.水银
(2)在钠、铝、铁三种金属元素中,所形成的氧化物中适宜做耐火材料的是_______,向盛有硫酸铝溶液的试管中滴加足量氨水,反应的离子方程式是_____________。
(3)乙同学为了获得持久白色的Fe(OH)2沉淀,准备用右图所示装置,用不含O2的蒸馏水配制的NaOH溶液与新制的FeSO4溶液反应。获得不含O2的蒸馏水的方法是_______。反应开始时,打开止水夹;一段时间后,关闭止水夹,在试管_______(填“A”或“B”)中观察到白色的Fe(OH)2。
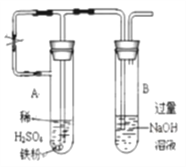
(4)向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是____________。
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无
(5)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。请写出FeCl3溶液与铜反应的离子方程式:__________;
(6)某研究性学习小组内测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:①取少量待测溶液,滴入KSCN溶液呈红色,该现象说明该溶液中含有的离子是_______;②验证该溶液中含有Fe2+,正确的实验方法是_______;A.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+B.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+C.观察溶液是否呈浅绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华诗句华丽优美且富含哲理,古人常将化学知识融入诗句中,以下诗句包含化学变化的是( )
A.千锤万凿出深山B.女娲炼石补天处
C.吹尽狂沙始到金D.多少楼台烟雨中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象的描述中不正确的是( )
选项 | 实验 | 现象 |
A | 加热放在坩埚中的一小块钠 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
B | 在酒精灯上加热铝箔 | 铝箔熔化时失去光泽,熔化的铝并不滴落好像有一层膜包着 |
C | 点燃的镁条伸入盛有O2的集气瓶(底部铺有少量细沙)中 | 镁条继续燃烧,发出耀眼的白光,放出大量的热,生成白色固体 |
D | 在空气中久置的铝条放入NaOH溶液中 | 立刻产生大量无色气泡,铝条逐渐变细,放出大量的热 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如右图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )

A. 6:1 B. 3:1 C. 2:1 D. 1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,下列说法不正确的是( )
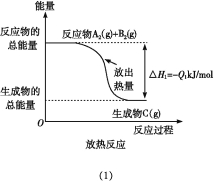

A.反应过程(1)的热化学方程式为A2(g)+B2(g)C(g)ΔH1=-Q1 kJ/mol
B.反应过程(2)的热化学方程式为C(g)A2(g)+B2(g)ΔH2=+Q2 kJ/mol
C.Q1与Q2的关系:Q1>Q2
D.ΔH2>ΔH1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com