
| 选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
| A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
| B | 0.01 | c(Na+)>c(AlO2-)>c(OH-)>c(CO32-) |
| C | 0.015 | c(Na+)>c(HCO3-)>c(CO32-)>C(OH-) |
| D | 0.03 | c(Na+)>c(HCO3-)>c(OH-)>c(H+) |
| A. | A | B. | B | C. | C | D. | D |
分析 通入二氧化碳首先进行的反应为氢氧化钠和二氧化碳反应生成碳酸钠和水,0.02mol氢氧化钠消耗0.01mol二氧化碳,生成0.01mol碳酸钠,然后偏铝酸钠和二氧化碳反应生成氢氧化铝和碳酸钠,0.01mol偏铝酸钠消耗0.005mol二氧化碳,生成0.005mol碳酸钠.然后再通入二氧化碳,二氧化碳和碳酸钠反应生成碳酸氢钠,消耗0.015mol的二氧化碳,生成0.03mol的碳酸氢钠,由此分析各选项.
解答 解:A、未通入二氧化碳时,溶液中的电荷守恒有c(Na+)+c(H+)=c(AlO2-)+c(OH-),故A错误;
B、当二氧化碳为0.01mol,所得溶液为0.01mol碳酸钠和0.01mol偏铝酸钠,因为碳酸酸性强于氢氧化铝,所以偏铝酸根离子水解程度比碳酸根离子强,则偏铝酸根离子浓度小于碳酸根离子浓度,所以溶液中离子的物质的量浓度大小为:c(Na+)>c(CO32-)>c(AlO2-)>c(OH-),故B错误;
C、当二氧化碳为0.015mol时,所以得溶液为0.015mol碳酸钠,溶液中离子浓度的关系为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-),故C错误;
D、当二氧化碳的量为0.03mol时,所得溶质为碳酸氢钠,水解程度大于电离程度,溶液显碱性,所以离子浓度大小顺序为:c(Na+)>c(HCO3-)>c(OH-)>c(H+),故D正确;
故选D.
点评 本题考查了溶液中离子浓度大小比较,主要掌握盐类水解的分析判断,注意守恒原理在解题中的应用,题目有一定的难度.


科目:高中化学 来源: 题型:选择题
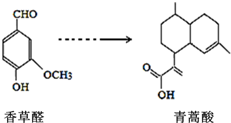 青蒿酸是合成青蒿素的原料,可以由香草醛合成:下列叙述不正确的是( )
青蒿酸是合成青蒿素的原料,可以由香草醛合成:下列叙述不正确的是( )| A. | 青蒿酸可以发生酯化反应 | |
| B. | 青蒿酸环上的一氯代物有10种 | |
| C. | 香草醛和H2反应,最多消耗H24 mol | |
| D. | 可用FeCl3溶液或NaHCO3溶液鉴别香草醛和青蒿酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用盐酸洗涤过滤 | B. | 用加热还原 | ||
| C. | 用CO加热还原 | D. | 用NaOH溶液洗涤,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时,电解质溶液中K+向阳极移动 | |
| B. | 充电时,电解质溶液中c(OH-)逐渐减小 | |
| C. | 放电时,负极反应为:Zn+4OH--2e-═Zn(OH)42- | |
| D. | 放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧气比臭氧稳定 | |
| B. | 所有吸热反应不一定都要加热反应才能进行 | |
| C. | 断裂3mol氧气中的化学键吸收的能量大于形成2mol臭氧中的化学键放出的能量 | |
| D. | 3mol氧气的总能量比2mol臭氧的总能量高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
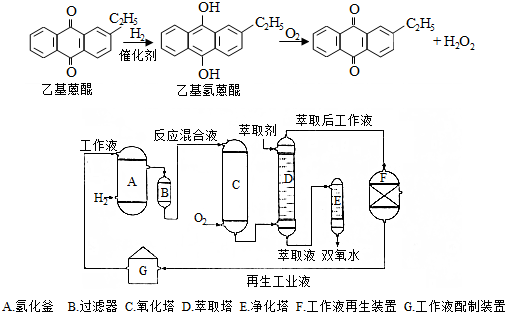
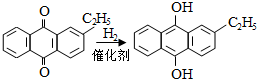 .进入氧化塔C的反应混合液中的主要溶质为乙基氢蒽醌.
.进入氧化塔C的反应混合液中的主要溶质为乙基氢蒽醌.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
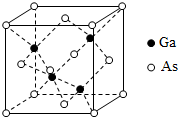 砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等.回答下列问题:
砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,测得氯化铵溶液pH<7,证明一水合氨是碱:NH4++2H2O═NH3•H2O+H3O+ | |
| B. | 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | 用碳酸氢钠溶液检验水杨酸中的羧基: +2HCO3-→ +2HCO3-→ +2H2O+2CO2↑ +2H2O+2CO2↑ | |
| D. | 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-═2Mn2++10CO2↑+8H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com