
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
A.C(s)+CO2(g) 2CO(g) 2CO(g) | B.3H2(g)+N2(g) 2NH3(g) 2NH3(g) |
C.H2(g)+I2(g) 2HI(g) 2HI(g) | D.C(s)+H2O(g) CO(g) + H2(g) CO(g) + H2(g) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.34 | B.0.64 | C.0.44 | D.0.54 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.单位时间内消耗a mol A,同时生成3a mol C |
| B.容器内压强不再变化 |
| C.单位时间内消耗2a mol B,同时消耗3a mol C |
| D.混合气体的平均摩尔质量不再变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)  FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1 173 K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1 173 K情况下,K1、K2的值分别如下:| 温度 | K1 | K2 |
| 973 K | 1.47 | 2.38 |
| 1173 K | 2.15 | 1.67 |
 推断:反应①是 (填“吸热”或“放热”)反应。
推断:反应①是 (填“吸热”或“放热”)反应。 CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3= ,根据反应①与②可推导出K1、K2与K3之间的关系式 ,据此关系式及上表数据,也能推断出反应③
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3= ,根据反应①与②可推导出K1、K2与K3之间的关系式 ,据此关系式及上表数据,也能推断出反应③ 是 (填“吸热”或“放热”)反应。
是 (填“吸热”或“放热”)反应。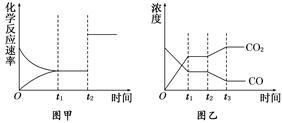
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g)△H > 0 。下列反应条件都有利于生成C的是
2C(g)△H > 0 。下列反应条件都有利于生成C的是| A.低温、低压 | B.高温、高压 | C.低温、高压 | D.高温、低压 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO2+O2?2NO+O2
2SO2+O2?2NO+O2 2NO2?
2NO2?查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NO2–Q(Q>0),其N2O4和NO2浓度变化如图如示。
2NO2–Q(Q>0),其N2O4和NO2浓度变化如图如示。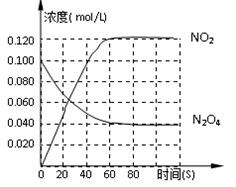
|
 0s间平衡向逆反应方向移动,可能的原因是( )
0s间平衡向逆反应方向移动,可能的原因是( )查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" kJ·mol-1、c(B)="0.200" kJ·mol-1及c(C)="0" kJ·mol-1。反应物A的浓度随时间的变化如下图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" kJ·mol-1、c(B)="0.200" kJ·mol-1及c(C)="0" kJ·mol-1。反应物A的浓度随时间的变化如下图所示。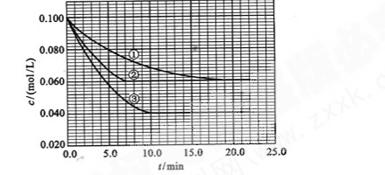
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com