
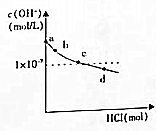
| 坐标对应点 | a | b | c | d |
| n(SO32-)n:(HSO3-) | 91:9 | 1:1 | 9:91 | |
| pH | >8.2 | 8.2 | 7.2 | 6.2 |
| A. | b点溶液中:水电离出的c(OH-)=1×10-5.8mol/L | |
| B. | c点溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+) | |
| C. | d点溶液中HSO3-的电离大于水解 | |
| D. | d点溶液中:c(Na+)<c(SO32-)+c(HSO3-)+c(Cl-) |
分析 a点溶液PH>8.2,溶液显碱性,是亚硫酸钠溶液中亚硫酸根离子水解的原因,向1L0.1mol/L的Na2SO3溶液中滴加盐酸(假设反应前后溶液体积不变),溶液中水电离出的OH-离子浓度随盐酸的用量关系,由表格中的数据可知,HSO3-越多,酸性越强,则电离生成氢离子;吸收液呈中性时,溶质为亚硫酸钠和亚硫酸氢钠,电离与水解的程度相等,
A.b点溶液中存在离子积常数,溶液PH=8.2,c(H+)=10-8.2mol/L,水电离出的c(OH-)=$\frac{Kw}{c({H}^{+})}$;
B.c点溶液PH=7.2,n(SO32-)n:(HSO3-)=1:1,溶液显碱性说明亚硫酸氢根离子电离大于亚硫酸根离子水解,溶液中c(OH-)>c(H+),c(SO32-)>c(HSO3-);
C.d点溶液PH=6.2溶液显酸性,n(SO32-)n:(HSO3-)=9:91,所以溶液中为NaHSO3,NaCl溶液PH<7,说明HSO3-的电离大于水解;
D.d点溶液中存在电荷守恒,溶液显酸性c(OH-)<c(H+);
解答 解:A.b点溶液中存在离子积常数,溶液PH=8.2,c(H+)=10-8.2mol/L,水电离出的c(OH-)=$\frac{Kw}{c({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-8.2}}$mol/L=1×10-5.8mol/L,故A正确;
B.c点溶液PH=7.2,n(SO32-)n:(HSO3-)=1:1,溶液显碱性说明亚硫酸氢根离子电离大于亚硫酸根离子水解,溶液中c(OH-)>c(H+),c(SO32-)>c(HSO3-),溶液中离子浓度c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+),故B正确;
C.d点溶液PH=6.2溶液显酸性,n(SO32-)n:(HSO3-)=9:91,所以溶液中为NaHSO3,Na2SO3,NaCl,溶液PH<7,说明HSO3-的电离大于水解,故C正确;
D.d点溶液中存在电荷守恒,c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)+c(Cl-),c(H+)>c(OH-),溶液显酸性c(Na+)<2c(SO32-)+c(HSO3-)+c(Cl-),故D错误;
故选D.
点评 本题考查了图象分析,弱电解质电离平衡,盐类水解平衡,电解质溶液中离子浓度大小比较,溶液中电荷守恒、物料守恒等知识的应用,题目难度中等.


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{36V}$mol/L | B. | $\frac{a}{18V}$mol/L | C. | $\frac{a}{54V}$mol/L | D. | $\frac{a}{27V}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X/m mol | B. | 2X/3mol | C. | (X+Y)mol | D. | 2(X+Y)/3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
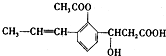 ,下列有关该有机化合物的说法不正确的是
,下列有关该有机化合物的说法不正确的是| A. | 含有四种官能团 | |
| B. | 能发生取代、加成、消去、氧化等反应• | |
| C. | 1mol该有机物最多可以与2molNaOH反应 | |
| D. | 该有机物属于芳香族化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
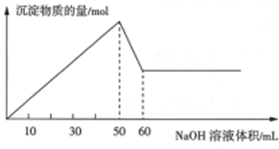
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环乙醇 | 0.96 | 25.93 | 161 | 能溶于水 |
| 环乙烯 | 0.81 | -103 | 83 | 难溶于水 |
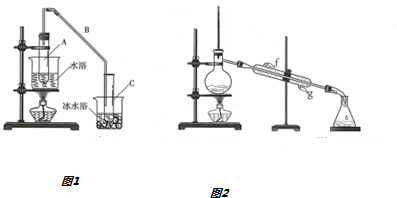
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com