
分析 (1)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
(2)二价铁离子具有还原性,能够还原 高锰酸钾;
(3)酸性环境下过氧化氢氧化铜生成铜离子;
(4)二氧化硅与碳反应生成硅和一氧化碳.
解答 解:(1)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)二价铁离子具有还原性,能够还原 高锰酸钾,所以检验二价铁离子可以用酸性的高锰酸钾溶液,离子方程式:取少量待测液于试管中,滴加几滴高锰酸钾溶液,若紫色退去,则含有FeSO4,反之则无;
故答案为:取少量待测液于试管中,滴加几滴高锰酸钾溶液,若紫色退去,则含有FeSO4,反之则无;
(3)用H2O2和稀H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,反应生成硫酸铜和水,离子方程式:Cu+2H++H2O2═Cu2++2H2O;
故答案为:Cu+2H++H2O2═Cu2++2H2O;
(4)二氧化硅与碳反应生成硅和一氧化碳,化学方程式:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO+Si;
故答案为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO+Si.
点评 本题考查了离子方程式、化学方程式的书写、离子的检验,明确物质性质及发生反应实质是解题关键,题目难度中等.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫化钠的电子式: | |
| B. | 氯原子的结构示意图: | |
| C. | 氢氧根离子的电子式: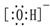 | |
| D. | 质量数为146、中子数为54的铀(U)原子:${\;}_{54}^{146}$U |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 共价键 | 断开该键吸收的能量或生成该键放出的能量/kJ•mol-1 | 共价键 | 断开该键吸收的能量或生成该键放出的能量/kJ•mol-1 | 共价键 | 断开该键吸收的能量或生成该键放出的能量/kJ•mol-1 |
| H-H | 436 | H-Br | 366 | Cl-Cl | 243 |
| H-O | 463 | H-I | 298 | Br-Br | 193 |
| H-Cl | 432 | O=O | 496 | I-I | 151 |
| A. | ①④ | B. | ②③ | C. | 只有① | D. | 只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2014年8月28日,第二届夏季青年奥林匹克运动会(以下简称“青奥会”)在南京奥体中心顺利闭幕.请完成下列与“青奥会”有关的填空.
2014年8月28日,第二届夏季青年奥林匹克运动会(以下简称“青奥会”)在南京奥体中心顺利闭幕.请完成下列与“青奥会”有关的填空.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是 ( )
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是 ( )| A. | HA为强酸 | B. | 该混合溶液中:c(A-)+c(Y)=c(Na+) | ||
| C. | 图中X表示HA,Y表示H+,Z表示OH- | D. | 该混合液pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤操作中,漏斗的尖端应接触烧杯内壁 | |
| B. | 用玻璃棒蘸取CH3COOH溶液点在水湿润的pH试纸上,测定该溶液的pH | |
| C. | 中和滴定时.滴定管用所盛装的反应液润洗2~3 次. | |
| D. | 分液操作中,下层液体从下端放出,上层液体从上口倒出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com