
某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
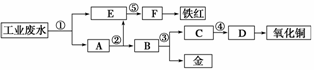
填写下面空白:
(1)图中标号处需加入的相应物质分别是
①____________、②____________、③____________、
④____________、⑤____________。
(2)写出①处发生反应的离子方程式
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________;
写出③处发生反应的化学方程式
________________________________________________________________________
________________________________________________________________________。
(3)铁红的化学式为________;分别写出铁红和氧化铜在工业上的一种主要用途:
铁红___________________________________________________________________;
氧化铜_________________________________________________________________。
(1)①铁屑 ②稀硫酸(盐酸) ③稀硝酸 ④氢氧化钠 ⑤氢氧化钠
(2)Fe+2H+===Fe2++H2↑,2Fe3++Fe===3Fe2+,Cu2++Fe===Cu+Fe2+,2Au3++3Fe===2Au+3Fe2+ 3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
(3)Fe2O3 用作红色涂料 用作制造铜盐的原料
解析 (1)本实验的目的是用废铁屑、常用的酸和碱,从废水中回收金,并生产一定量的铁红和氧化铜。而废水中含有Fe3+、Cu2+、Au3+,因此首先加入废铁屑将Cu和Au都置换出来。Cu和Au的分离可以利用Cu与稀硝酸能反应而Au不能,将其分离,Cu2+和Fe2+分别加入碱使其转化为沉淀,灼烧分别生成它们的氧化物。
(2)由于废水显酸性,又含有Cu2+、Au3+、Fe3+,因此加入铁屑发生反应的离子方程式为:
Fe+2H+===H2↑+Fe2+;
Fe+Cu2+===Cu+Fe2+;
3Fe+2Au3+===2Au+3Fe2+;
2Fe3++Fe===3Fe2+。
(3)铁红的化学式为Fe2O3,铁红常用作红色颜料,氧化铜常用作制造铜盐的原料。


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
由1,3丁二烯合成氯丁橡胶的过程中, 是一种中间产物。下列说法正确的是
A.1,3丁二烯分子式为C4H8
B.1,3丁二烯转化为 时,先与Cl2发生1,4加成再水解得到
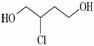
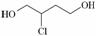
 C. 在NaOH醇溶液中或浓硫酸存在时加热都能发生消去反应
C. 在NaOH醇溶液中或浓硫酸存在时加热都能发生消去反应
 D. 催化氧化得X,X能发生银镜反应,则X的结构只有两种
D. 催化氧化得X,X能发生银镜反应,则X的结构只有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作能达到实验目的的是
| 实验操作 | 实验目的 | |
| A | 苯和溴水混合后加入铁粉 | 制溴苯 |
| B | 乙醇与重铬酸钾(K2Cr2O7)酸性溶液混合 | 验证乙醇具有还原性 |
| C | 淀粉溶液加稀硫酸,水浴加热一段时间后,加新制备的Cu(OH)2,加热 | 证明淀粉水解后产生葡萄糖 |
| D | 向纯碱中滴加醋酸,将产生的气体通入苯酚钠浓溶液 | 证明酸性: 醋酸>碳酸>苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某物质E可做香料,其结构简式为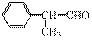 ,工业合成路线如下:
,工业合成路线如下:
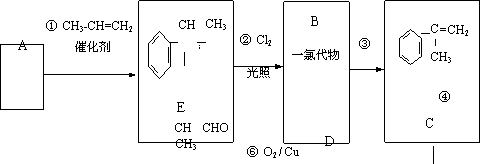 |
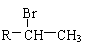 已知:
已知:
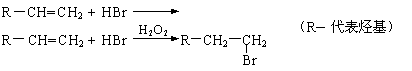 |
回答下列问题:
(1)A为芳香烃,相对分子质量为78。下列关于A的说法中,正确的是______(填序号);
a.密度比水大
b.所有原子均在同一平面上
c.一氯代物只有一种
(2)B的结构简式可能是 、 ;
(3)步骤④的化学方程式是 ;
(4)E有多种同分异构体,写出符合以下条件的结构简式 (只写反式结构)。
① 具有顺反结构
② 能与NaOH溶液反应
③ 分子中苯环上的一溴代物有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH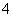 、Cl-、Mg2+、Ba2+、CO
、Cl-、Mg2+、Ba2+、CO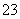 、SO
、SO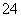 ,现取三份100 mL溶液进行如下实验:
,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生。
(2)第二份加足量NaOH溶液加热后,收集到气体0.04 mol。
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。
根据上述实验,以下推测正确的是( )
A.K+不一定存在
B.100 mL溶液中含0.01 mol CO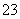
C.Cl-可能存在
D.Ba2+一定不存在,Mg2+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关原电池的说法中正确的是( )
A.在外电路中,电子由负极流向正极
B.在原电池中,相对较活泼的金属作负极,不活泼的金属作正极
C.原电池工作时,正极表面一定有气泡产生
D.原电池工作时,可能会伴随着热能变化
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、M和N均为短周期元素,X、Y、Z原子序数依次增大且最外层电子数之和为15,X与Z可形成XZ、XZ2型分子, Y与M气态化合物标准状况下密度约0.76g/L。N的原子半径为短周期元素中最大。回答下列问题:
(1)M、Z和N的元素符号分别为 、 、 。
(2)X、Y、Z、M四种元素的原子半径由大到小的顺序为 。
(3)由上述元素组成、既含有共价键又含有离子键的化合物,其中含有极性共价键或含有非极性共价键,各举一例用电子式表示为 、 。
(4)X和Y组成的离子XY-对环境有害,可在NaClO的碱性溶液中转化为碳酸盐和氮气,相应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com