
 X、Y、Z、W为前四周期的元素,其原子序数依次增大.Y元素最外层电子数是其内层电子数的3倍.X与Y形成的常见化合物多于两种.Z与Y、W分处不同周期,且Z的离子是构成叶绿素中重要大环有机物的中心离子.W被称为继铁、铝之后的第三金属.请根据上述信息回答下列问题:
X、Y、Z、W为前四周期的元素,其原子序数依次增大.Y元素最外层电子数是其内层电子数的3倍.X与Y形成的常见化合物多于两种.Z与Y、W分处不同周期,且Z的离子是构成叶绿素中重要大环有机物的中心离子.W被称为继铁、铝之后的第三金属.请根据上述信息回答下列问题: ,
, ;
;| 5-1-2×2 |
| 2 |
 ,假设该晶胞中的钛原子的直径为a pm,则正四面体的棱长为a pm,正四面体如图
,假设该晶胞中的钛原子的直径为a pm,则正四面体的棱长为a pm,正四面体如图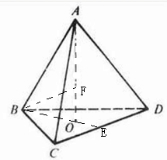 ,即AB长=a pm,BO长=a pm×
,即AB长=a pm,BO长=a pm×
| ||
| 2 |
| 2 |
| 3 |
| ||
| 3 |
a2-(
|
| ||
| 3 |
| ||
| 3 |
2
| ||
| 3 |
2
| ||
| 3 |
| ||
| 2 |
| ||
| 2 |
| ||
| 2 |
2
| ||
| 3 |
| 2 |
| 1 |
| 8 |
| 48 |
| NA |
| 48 |
| NA |
| 2 |
48
| ||
| a3×NA |
48
| ||
| a3×NA |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、①②③④ | B、③①②④ |
| C、②③①④ | D、②④①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 按如图所示操作,充分反应后:
按如图所示操作,充分反应后:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com